汽车安全气囊是德国安全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的粉末进行实验。经组成分析,确定该粉末仅含Na、Fe、N、O四种元素。水溶性试验表明,固体粉末部分溶解。经检测,可溶物为化合物甲,不溶物为红棕色固体,可溶于盐酸。取13.0 g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72 L。单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另外一种单质。化合物丙与空气接触可转化为可溶性盐。请回答下列问题:
(1)甲的化学式为_________,丙的电子式为__________
(2)若丙在空气中转化为碳酸氢盐,则反应的化学方程式为____________________
(3)单质乙与红棕色粉末发生反应的化学方程式为_______________________。安全气囊中红棕色粉末的作用是_________________
(4)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是____。
A.KCl B.KNO3 C.Na2S D.CuO
(5)设计一个实验方案,探究化合物丙与空气接触后生成可溶性盐的成分(不考虑结晶水合物)
___________________。
(1)Na3N;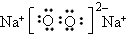
(2)2Na2O2+4CO2+2H2O=4NaHCO3+O2
(3)6Na+2Fe2O3=3Na2O2+4Fe;充当氧化剂,除去氮化钠分解产生的金属钠(金属钠溶于水产生大量的热和碱性有害物质)提供大量的热量用于氮化钠的迅速分解
(4)D
(5)实验目的:检验Na2O2在空气中与水或二氧化碳反应的产物,即检验NaOH和Na2CO3或NaHCO3。
实验设计一:
实验原理:定量分析法。
步骤:①称量混合固体的质量。②将混合物加热,并将气体通入澄清石灰水,无现象则无NaHCO3,石灰水变浑浊,则有NaHCO3无NaOH,称量石灰水质量变化量mg。③加入过量盐酸,将产生的气体通入澄清石灰水,称量石灰水质量增加量ng。④通过m与n 的计算获得最终结果。
实验设计二:
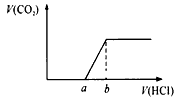
实验原理:测定盐酸用量与产生二氧化碳的量的关系确定混合物成分。
①不产生二氧化碳则混合物只有 NaOH。②开始产生二氧化碳前,与开始产生二氧化碳直到最大量消耗的盐酸的体积比为1:1,则只有Na2CO3。大于1:1 则为NaOH与Na2CO3的混合物。小于1:1则为
Na2CO3和NaHCO3的混合物。即比较下图中a、b的大小。