(1)固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如右图所示(实线)。图中数据a(1,6)代表的意思是:在l min时H2的物质的量是6mol。
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如右图所示(实线)。图中数据a(1,6)代表的意思是:在l min时H2的物质的量是6mol。
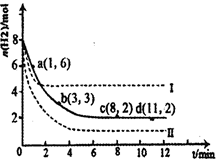
①下列时间段平均反应速率最大的是__________,最小的是______________。
A.0~1min
B.1~3min
C.3~8min
D.8~11min②仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示,曲线Ⅰ对应的实验改变的条件是________,曲线Ⅱ对应的实验改变的条件是_________。
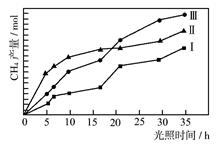
(2)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,等量的CO2和H2O(g)在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如图所示。在0~30 h内,CH4的平均生成速率v(Ⅰ)、v(Ⅱ)和v(Ⅲ)从大到小的顺序为 。反应开始后的12小时内,在第___________种催化剂的作用下,收集的CH4最多。
(12分)(1)①A、D ②升高温度,增大压强或者是增大CO2浓度(各2分)
(2)v(Ⅲ)>v(Ⅱ)>v(Ⅰ)(2分);Ⅱ (2分)
题目分析:(1)①由图1可知,0~1min内氢气的变化量为8mol-6mol=2mol;
B.1~3min内氢气的变化量为6mol-3mol=3mol,平均1min变化量为1.5mol;
C.3~8min内氢气的变化量为3mol-2mol=1mol,平均1min变化量为0.2mol;
D.8~11min达平衡状态,氢气的物质的量不再变化.
故1~3min速率增大,8~11min速率最小.
故答案为:A;D.
②对于可逆反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1,正反应是体积减小的放热反应.
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1,正反应是体积减小的放热反应.
由图1可知,曲线Ⅰ最先到达平衡,平衡时氢气的物质的量增大,故改变条件应增大反应速率且平衡向逆反应移动,可以采取的措施为:升高温度.
曲线Ⅱ到达平衡的时间比原平衡短,平衡时氢气的物质的量减小,故改变条件应增大反应速率且平衡向正反应移动,可以采取的措施为:增大压强或者是增大CO2浓度.
故答案为:升高温度;增大压强或者是增大CO2浓度.
(2)由图2可知,在0~30h内,甲烷的物质的量变化量为△n(Ⅰ)<△n(Ⅱ)<△n(Ⅲ),故在0~30h内,CH4的平均生成速率v(Ⅲ)>v(Ⅱ)>v(Ⅰ);
由图2可知反应开始后的12小时内,在第Ⅱ种催化剂的作用下,收集的CH4最多.
故答案为:v(Ⅲ)>v(Ⅱ)>v(Ⅰ);Ⅱ.
