在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应应:
A(g) B(g)+C(g) △H ="+85.1" kJ· mol-1
B(g)+C(g) △H ="+85.1" kJ· mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为 。
(2)由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为 。
平衡时A的转化率为 ,列式并计算反应的平衡常数K 。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),
n总= mol,n(A)= mol。
②下表为反应物A浓度与反应时间的数据,计算a=
| 反应时间t/h | 0 | 4 | 8 | 16 |
| c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.0065 |
(1)升高温度、降低压强
(2)α(A)=(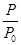 -1)×100%;94.1%;K=
-1)×100%;94.1%;K=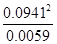 =1.5;
=1.5;
(3)①0.1×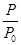 ;0.1×(2-
;0.1×(2-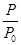 );
);
②0.051;每间隔4小时,A的浓度为原来的一半。0.013
题目分析:(1)根据反应是放热反应特征和是气体分子数增大的特征,要使A的转化率增大,平衡要正向移动,可以采用升高温度、降低压强的方法。
(2)反应前气体总物质的量为0.10mol,令A的转化率为α(A),改变量为0.10α(A) mol,根据差量法,气体增加0.10α(A)mol,由阿伏加德罗定律列出关系:
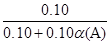 =
=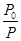 α(A)=(
α(A)=(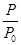 -1)×100%;α(A)=(
-1)×100%;α(A)=(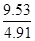 -1)×100%=94.1%
-1)×100%=94.1%
平衡浓度C(C)=C(B)=0.1×94.1%=0.0941mol/L,C(A)=0.1-0.0941=0.0059mol/L,K=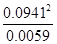 =1.5
=1.5
(3)①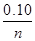 =
=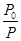 n=0.1×
n=0.1×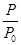 ;其中,n(A)=0.1-(0.1×
;其中,n(A)=0.1-(0.1×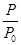 -0.1)=0.1×(2-
-0.1)=0.1×(2-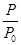 )
)
②n(A)=0.1×(2-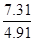 )=0.051 C(A)=0.051/1=0.051mol/L
)=0.051 C(A)=0.051/1=0.051mol/L
每间隔4小时,A的浓度为原来的一半。当反应12小时时,C(A)=0.026/2=0.013mol/L
