化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1)常温下,取 pH=2的盐酸和醋酸溶液各100mL, 向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是 ( 填“A”或“B”)。 设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。 则 m1 m2 ( 选填“<”、“=”、“>”)

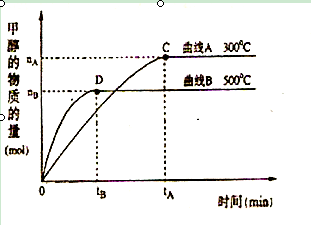
(2)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO ( g) + 2H2( g) → CH3OH(g) 。反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)常温下,某纯碱溶液中滴入酚酞,溶液呈红色。说明该溶液呈 性。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论) 。
(1)B (1分); < (1分);
(2)K=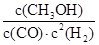 (1分) ; 减小 (1分) ;
(1分) ; 减小 (1分) ; 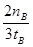 mol•L-1•min-1 (1分);
mol•L-1•min-1 (1分);
(3)碱 (1分); 向红色溶液中加入足量BaCl2溶液,如果溶液还显红色说明甲正确,红色褪去说明乙正确 (2 分)。(其它合理答案也给分)
题目分析:(1)醋酸为弱电解质,其溶液存在电离平衡,与Zn反应使平衡向右移动,pH变化小,故B曲线表示醋酸的pH变化曲线;pH相同醋酸的物质的量大,故与醋酸反应的Zn质量大。
(2)按照平衡常数的含义可得平衡常数表达式;随着反应的进行H2浓度自己减小,所以氢气的平均反应速率减小;v(H2)="2" v(CH3OH)=2×nBmol÷3L÷tBmin=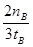 mol•L-1•min-1。
mol•L-1•min-1。
(3)碱性溶液使酚酞变红;根据NaOH和Na2CO3的性质,N a2CO3与BaCl2反应生成BaCO3沉淀而NaOH与BaCl2不反应,所以用BaCl2溶液检验。
