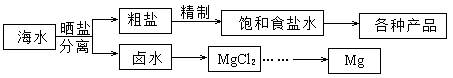
(1)用NaCl做原料可以得到多种产品。
①工业上由NaCl制备金属钠的化学方程式是 。
②实验室用惰性电极电解100mL0.1mol/L NaCl溶液,若阴阳两极均得到11.2mL气体(标准状况),则所得溶液的pH为 (忽略反应前后溶液的体积变化)。
③电解NaCl稀溶液可制备“84消毒液”,通电时产生的氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出该电解的化学方程式: 。
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。粗产品的溶液中含有Na+、Fe2+,Fe3+和Mn2+,需将Fe2+、Fe3+和Mn2+转化为沉淀除去。Fe(OH)2呈絮状,常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表)。若只加一种上述(1)中得到的产品,该物质的化学式为 ,控制溶液的pH为 。
| 物 质 | 开始沉淀 | 沉淀完全 | 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 2.7 | 3.7 | Mn(OH)2 | 8.3 | 9.8 |
| Fe(OH)3 | 7.6 | 9.6 | Mg(OH)2 | 9.9 | 11.1 |
(1)①2NaCl+2H2O=2NaOH+H2↑+Cl2↑②13③NaCl+H2O NaClO+H2↑
NaClO+H2↑
(2)NaClO或氯气,9.8
海水中氯化钠的含量十分丰富,NaCl为重要的化工原料。(1)①NaCl为离子化合物,电解其熔融物,钠离子得电子生成熔融金属钠,Cl-离子失电子得到Cl2;②电解氯化钠溶液反应的化学方程式为:2NaCl+2H2O=2NaOH+H2↑+Cl2↑,n(NaOH)=n(H2)=2×112mL/22400mL·mol-1=0.01 mol,c(OH-)="c(NaOH)=0.01mol/0.1L=0.1" mol·L-1,溶液的pH为14-lg0.1=13。③电解NaCl溶液制备84消毒液是将电解产生的Cl2与电解产生的NaOH反应生成NaClO,故该电解反应方程式为NaCl+H2O NaClO+H2↑。
NaClO+H2↑。
(2)将Fe2+离子转化为Fe3+离子需要加入氧化剂,可以选用NaClO或氯气,要使沉淀杂质沉淀完全,需要调整溶液的pH为9.8,过高Mg(OH)2会产生沉淀。
