碳酸二甲酯(DMC)是一种近年来受到广泛关注的环保型绿色化工产品。在催化剂作用下,可由甲醇和CO2直接合成DMC:CO2 + 2CH3OH → CO(OCH3)2 + H2O,但甲醇转化率通常不会超过1%是制约该反应走向工业化的主要原因。某研究小组在其他条件不变的情况下,通过研究温度、反应时间、催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果。计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量。
(1)已知25℃时,甲醇和DMC的标准燃烧热分别为△H1和△H2,则上述反应在25℃时的焓变△H3=_____。
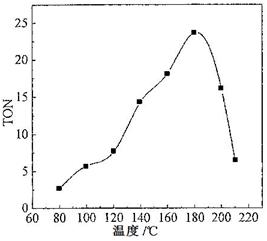
(2)根据反应温度对TON的影响图(下左图)判断该反应的焓变△H________0(填“>”、“=”或“<”),理由是________________________________。
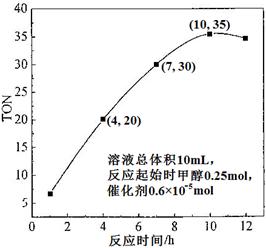
(3)根据反应时间对TON的影响图(上右图),已知溶液总体积10mL,反应起始时甲醇0.25mol,催化剂0.6×10—5 mol,计算该温度下,4~7 h内DMC的平均反应速率:________;计算10 h时,甲醇的转化率:________。
(4)根据该研究小组的实验及催化剂用量对TON的影响图(下图),判断下列说法正确的是___ __。
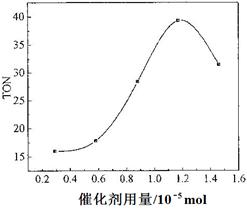
a. 由甲醇和CO2直接合成DMC,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义
b. 在反应体系中添加合适的脱水剂,将提高该反应的TON
c. 当催化剂用量低于1.2×10—5 mol时,随着催化剂用量的增加,甲醇的平衡转化率显著提高
d. 当催化剂用量高于1.2×10—5 mol时,随着催化剂用量的增加,DMC的产率反而急剧下降
(15分)
(1)2△H1 — △H2 (3分)
(2)< (2分) 经过相同的反应时间,温度较低时,反应未达到平衡;温度较高时,反应已达到平衡,随着温度升高,TON减小,即平衡向左移动,说明该反应放热(3分)
(3)1×10-3 mol·L-1·h-1( 2分) 8.4×10-2 % (2分)
(4)ab(3分)
题目分析:
(1)根据反应①CH3OH(l)+1.5O2(g)=CO2(g)+2H2O(l) ΔH1,②CO(OCH3)2(l)+3O2(g)=3CO2(g)+3H2O(l) ΔH1,根据盖斯定律有目标反应等于①×2-②,故有ΔH3=2ΔH1-ΔH2
(2)根据图可知,温度升高,平衡逆向移动,故正反应放热ΔH<0;
(3)4h,TON=20,7h,TON=30,ΔTON=10,Δ甲醇=10×0.6×10-5mol=0.6×10-4mol,速率为0.6×10-4mol÷0.01L÷3h=2×10-3 mol·L-1·h-1,10h,转化的甲醇为35×0.6×10-5mol=2.1×10-4mol,转化率为2.1×10-4mol÷0.25mol=8.4×10-2 %
(4)a、正确,b、减少水,使平衡正向移动,正确;cd、TON和转化率不是一样,错误;
