Ⅰ.(4分)在一体积为10L密闭的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
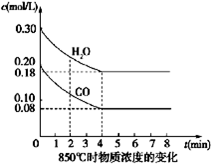
(1)CO和H2O浓度变化如图,则0~4 min的平均反应速率ν(CO)=_______ mol/(L·min),此时该反应的平衡常数为 。
(2)当下列哪些物理量不再发生变化时,表明上述反应已达到平衡状态的是 。
A.混合气体的压强
B.混合气体的密度
C.CO的物质的量浓度
D.密闭容器中放出热量E.ν(CO)与ν(CO2)的比值
Ⅱ.(6分)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
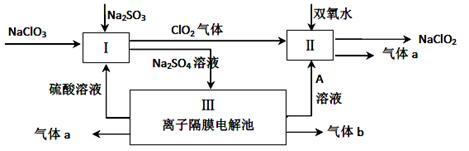
(3)配平Ⅰ中反应方程式 ClO3-+ H++ SO32-== ClO2↑+ SO42-+
(4)A的化学式是 ,。生成气体a的电极反应式 。
Ⅰ.(4分)(1)0.03;(1分)1(1分)(2)CD (2分)
Ⅱ.(6分)(3)2 ClO3-+ 2 H++ 1 SO32-== 2 ClO2↑+ 1SO42-+ 1 H2O (2分)
(4)NaOH;(2分))4OH-—4e-=2H2O+O2↑(2分)
题目分析:Ⅰ.(1)υ=∆c÷∆t=(0.20mol/l−0.08mol•L‾1)÷4min =0.03mol/(L•min),
用三段式法计算:
CO(g)十H2O(g) 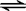 CO2(g)十H2 (g)
CO2(g)十H2 (g)
起始:0.20mol/L 0.30mol/L 0 0
转化:0.12mol/L 0.12mol/L 0.12mol/L 0.12mol/L
平衡:0.08mol/L 0.18mol/L 0.12mol/L 0.12mol/L
则
K=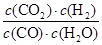 =
=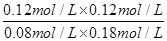 =1,
=1,
(2)A、无论是否达到平衡,气体总物质的量都不变,混合气体的压强不变,不能表明达到平衡;B、无论是否达到平衡,气体总质量不变,体积不变,所以混合气体的密度不变不能表明达到平衡;C、反应物的浓度不变,说明反应已达到平衡;D、密闭容器中放出热量不变,说明反应已达到平衡;E、ν(CO)与ν(CO2)的比值都是正反应速率,不论是否平衡都不变,所以不能表明反应已平衡,故CD正确。
Ⅱ.(3)根据化合价升降法,ClO3‾中Cl元素由+5价降低为ClO2中的+4价Cl,SO32‾中S元素由+4价升高到SO42‾中+6价S,通过化合价升高与降低数值相等可配平化学方程式。
(4)根据流程图可知气体a为氧气、气体b为氢气,同时生成A:NaOH,OH‾失电子生成O2,电极方程式为:4OH-—4e-=2H2O+O2↑。
