在80℃时,将0.40mo1的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4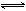 2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
| t/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(2)计算在80℃时该反应的平衡常数K= (请注明单位)。
(3)反应进行至100s后将反应混合物的温度升高,混合气体的颜色 (填“变浅”“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有 (填序号)。
A.增大N2O4的起始浓度
C.使用高效催化剂
B.向混合气体中通入NO2
D.升高温度
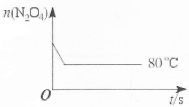
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出(不用计算,定性处理)该反应在60℃时N2O4物质的量的变化曲线。
(1)0.006
(2)1.8mol/L
(3)变深
(4)D
(5)如下图:
题目分析:(1)v(NO2)=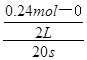 =0.006mol/(L•min);(2)起始时c(N2O4)=
=0.006mol/(L•min);(2)起始时c(N2O4)=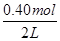 =0.20mol/L,平衡时c(NO2)=
=0.20mol/L,平衡时c(NO2)=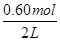 =0.30mol/L,则△c(NO2)=
=0.30mol/L,则△c(NO2)=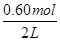 =0.30mol/L;由N2O4
=0.30mol/L;由N2O4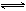 2NO2可知,△c(N2O4)=△c(NO2)/2=0.15mol/L,平衡时c(N2O4)=0.20mol/L—0.15mol/L=0.05mol/L;由K=
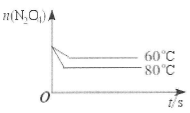
2NO2可知,△c(N2O4)=△c(NO2)/2=0.15mol/L,平衡时c(N2O4)=0.20mol/L—0.15mol/L=0.05mol/L;由K=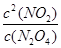 =1.8mol/L;(3)△H>0,则正反应是吸热反应,升高温度平衡正向移动,c(NO2)增大,则混合气体的颜色变深;(4)平衡常数只与温度有关,升高温度,平衡向正反应方向移动,K增大,故选D;(5)画图要点:起始时n(N2O4)相同;降低温度,反应速率减小,平衡向逆反应方向移动,则达到平衡的时间增大,且平衡时n(N2O4)增多。
=1.8mol/L;(3)△H>0,则正反应是吸热反应,升高温度平衡正向移动,c(NO2)增大,则混合气体的颜色变深;(4)平衡常数只与温度有关,升高温度,平衡向正反应方向移动,K增大,故选D;(5)画图要点:起始时n(N2O4)相同;降低温度,反应速率减小,平衡向逆反应方向移动,则达到平衡的时间增大,且平衡时n(N2O4)增多。
