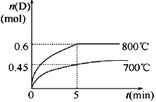
在容积为1 L的密闭容器中,进行如下反应: A(g)+2B(g) 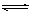 C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
请回答下列问题:
(1)700℃时,0~5min内,以B表示的平均反应速率为_______。
(2)能判断反应达到化学平衡状态的依据是__________。
A.容器中压强不变 B.混合气体中c(A)不变
C.v正(B)=2v逆(D) D.c(A)=c(C)
(3)若最初加入1.0 mol A和2.2 mol B,利用图中数据计算800℃时的平衡常数K=___ _______,该反应为__________反应(填“吸热”或“放热”)。
(4) 800℃时,某时刻测得体系中物质的量浓度如下:c(A)=0.06 mol/L,c(B)=0.50 mol/L,c(C)=0.20 mol/L,c(D)=0.018 mol/L,则此时该反应______ ____(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”)。
(1)0.18 mol/(L·min) (2)ABC (3)0.9 吸热
(4)向正方向进行
题目分析:(1)700℃时.0-5min内,D的平均化学反应速率v(D)=△n/(V•△t)=0.45mol/(1L×5min)
=0.09mol/(L•min),同一反应中,各物质的反应速率之比等于计量数之比,所以v(B):v(D)=2:1,
故v(B)=0.18mol•L-1•min-1;
(2)该反应是反应前后气体体积减小的反应,反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化;所以:
A:该反应是反应前后气体体积减小的反应,当压强不变时,各物质的浓度不再发生变化,故A正确;
B:反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,B正确;
C:v正(B)=2v逆(D),速率之比等于化学计量数之比,反应达平衡状态,故C正确;
D:无论反应是否达到平衡状态,c(A)=c(C),所以不能作为判断平衡状态的依据,故D错误;
(3) A(g)+2B(g)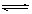 C(g)+D(g)
C(g)+D(g)
起始(mol/L) 1.0 2.2 0 0
反应(mol/L) 0.6 1.2 0.6 0.6
平衡(mol/L) 0.4 1.0 0.6 0.6
化学平衡常数K=(0.6mol/L×0.6mol/L)/[0.4mol/L×(1.0mol/L)2 ]=0.9(mol•L-1)-1;
根据图象知,降低温度D的含量减少,所以平衡向逆反应方向移动,故正反应是吸热反应。
(4)A、B、C、D各物质的浓度分别为c(A)=0.06 mol/L,c(B)=0.50 mol/L,c(C)=0.20 mol/L,c(D)=0.018 mol/L,浓度商QC="(0.2" mol/L×0.018 mol/L)/[0.06 mol/L×(0.5 mol/L)2 ]=0.24(mol•L-1)-1<0.9(mol•L-1)-1,所以反应向正反应方向进行。
