能源问题是人类社会面临的重大课题,甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。
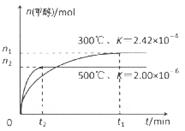
(1)用CO合成甲醇的反应为:CO(g)+2H2(g)  CH3OH(g)在容积为1L。的密闭容器中分别充入1molCO和2molH2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的△H_______0(填“<”、“>”或“=”),判断的理由是______。
CH3OH(g)在容积为1L。的密闭容器中分别充入1molCO和2molH2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的△H_______0(填“<”、“>”或“=”),判断的理由是______。
(2)利用工业废气中的CO2可制取甲醇,其反应为:CO2+3H2 CH3OH+H2O。
CH3OH+H2O。
①常温常压下已知下列反应的能量变化如下图所示:

由二氧化碳和氢气制备甲醇的热化学方程式为_______。
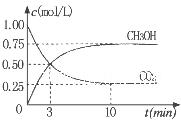
②为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入1molCO2和3molH2,进行上述反应。测得CO2。和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,v(H2)="_______" ;该温度下的平衡常数数值K=______。能使平衡体系中n(CH3OH)/n(CO2))增大的措施有_______(任写一条)。
(3)工业上利用甲醇制备氢气的常用方法有两种。
①甲醇蒸汽重整法。主要反应为;CH3OH(g)  CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60 molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1 =2.2,则该条件下CH3OH 的平衡转化率为______ 。
CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60 molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1 =2.2,则该条件下CH3OH 的平衡转化率为______ 。
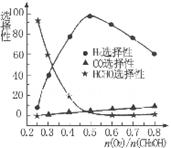
②甲醇部分氧化法。在一定温度下以Ag/CeO2-ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示。则当n(O2)/n(CH3OH) =0.25时。CH3OH与O2发生的主要反应方程式为______ 。在制备H2:时最好控制n(O2))/n(CH3OH)=______。
(1)<温度升高,平衡时甲醇的量减少,平衡逆向移动,则正反应放热(或温度升高,平衡常数减小,平衡逆向移动,则正反应放热)。(2)① CO2(g)+3H2(g)=CH3OH(l)+H2O(l) ΔH="-50KJ/mol." ②0.225mol/(L·min) 5.3 降低温度(或加压或增大H2的量或将H2O蒸汽从体系中分离等)。(3) ①60﹪ ②2CH3OH+O2 ="2HCHO+" 2H2O 0. 5
题目分析:(1)当反应达到平衡后,由于升高温度,n(CH3OH)减小,平衡时CH3OH的含量降低,说明升高温度,化学平衡向逆反应方向移动。根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动。逆反应方向是吸热反应,所以正反应是放热反应。故△H<0.(2) ①由图一可知:CO2(g)+H2(g)=CO(g)+H2O(l) △H="41KJ/mol," 由图二可知:CO(g)+2H2(g)  CH3OH(g) △H= -91KJ/mol.将两式相加可得:CO2(g) +3H2(g)=CH3OH(l)+H2O(l) ΔH="-50KJ/mol." ② V(CO2)=" (1.00-0.25)" mol/L÷10min=" 0.075mol/(l·min)." V(H2):V(CO2)=3:1,所以V(H2)="3" V(CO2)=" 0.225mol/(L·min)" . 在该温度下的平衡常数数值
CH3OH(g) △H= -91KJ/mol.将两式相加可得:CO2(g) +3H2(g)=CH3OH(l)+H2O(l) ΔH="-50KJ/mol." ② V(CO2)=" (1.00-0.25)" mol/L÷10min=" 0.075mol/(l·min)." V(H2):V(CO2)=3:1,所以V(H2)="3" V(CO2)=" 0.225mol/(L·min)" . 在该温度下的平衡常数数值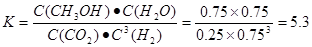 由于反应 CO2(g) +3H2(g)= CH3OH(l)+H2O(l) ΔH=-50KJ/mol.的正反应是一个放热反应,所以降低温度能使平衡体系中n(CH3OH)/n(CO2)增大。另外比如加压、增加H2的量或将水蒸气从混合物中分离出来等措施也能使平衡体系中n(CH3OH)/n(CO2))增大。(3)反应开始时n(CH3OH)=0.6mol,n(CO)=0mol,n(H2)=0mol.假设反应过程中CH3OH改变的物质的量为X,则达到平衡时各物质的物质的量为n(CH3OH)=" (0.6-X)mol," n(CO) ="Xmol" n(H2)=2Xmol,对于体积固定的密闭容器中的气体反应来说,反应前后的压强比等于它们的物质的量的比。所以(0.6+2X)÷0.6=2.2,解得X=0.36.所以CH3OH的平衡转化率为0.36÷0.6×100﹪=60﹪。②由图可知当n(O2)/n(CH3OH) =0.25时得到的产物是甲醛,CH3OH与O2发生的主要反应方程式为2CH3OH +O2="2HCHO+" 2H2O。在制备H2时由于在n(O2)/n(CH3OH) =0.5时选择性最高,所以最好控制n(O2))/n(CH3OH)= 0.5。
由于反应 CO2(g) +3H2(g)= CH3OH(l)+H2O(l) ΔH=-50KJ/mol.的正反应是一个放热反应,所以降低温度能使平衡体系中n(CH3OH)/n(CO2)增大。另外比如加压、增加H2的量或将水蒸气从混合物中分离出来等措施也能使平衡体系中n(CH3OH)/n(CO2))增大。(3)反应开始时n(CH3OH)=0.6mol,n(CO)=0mol,n(H2)=0mol.假设反应过程中CH3OH改变的物质的量为X,则达到平衡时各物质的物质的量为n(CH3OH)=" (0.6-X)mol," n(CO) ="Xmol" n(H2)=2Xmol,对于体积固定的密闭容器中的气体反应来说,反应前后的压强比等于它们的物质的量的比。所以(0.6+2X)÷0.6=2.2,解得X=0.36.所以CH3OH的平衡转化率为0.36÷0.6×100﹪=60﹪。②由图可知当n(O2)/n(CH3OH) =0.25时得到的产物是甲醛,CH3OH与O2发生的主要反应方程式为2CH3OH +O2="2HCHO+" 2H2O。在制备H2时由于在n(O2)/n(CH3OH) =0.5时选择性最高,所以最好控制n(O2))/n(CH3OH)= 0.5。
