在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g)+Q(Q>0),
2NH3(g)+Q(Q>0),
(1)该反应所用的催化剂是 (填写名称)
该反应450℃的平衡常数 500℃时的平衡常数(填“>”、“<”或“=”)。
(2)下列描述中能说明上述反应已达平衡的是
A.3V正(H2)=2V逆(NH3)
B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中气体的分子总数不随时间而变化(3)如上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol计算从反应开始到平衡时,平均反应速率v(N2)为______________mol/(L¯min)。
(4)下列研究目的和示意图相符的是 。
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P1>P2) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 | 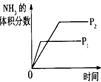 | 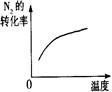 | 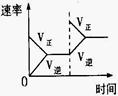 | 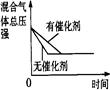 |
(1)铁触媒,﹥
(2)B D
(3)0.01 mol/L
(4)C
题目分析:(1)该反应所用的催化剂是触媒,由于该反应是放热反应,升高温度平衡逆向移动,故 该反应450℃的平衡常数应该大于500℃时的平衡常数。
(2)由于容器中气体的平均分子量和容器中气体的密度如果没有平衡始终在发生着变化,故选BD。
(3)根据反应速率的计算公式可求得v(N2)为0.01mol/(L¯min)。
(4)A.反应物气体的计量数大于生成物气体的计量数,则增大压强平衡向正反应方向移动,氨气的体积分数增大,压强越大反应速率越大,图象不符,故A错误;B.正反应放热,则升高温度平衡向逆反应方向移动,氮气的转化率降低,图象不符,故B错误;C.增加氮气,正反应速率增大,加入氮气瞬间逆反应速率不变,然后逐渐增大,重新达到平衡状态,图象符合,故C正确;D.加入催化剂,反应速率增大,达到平衡所用时间少,图象不符合,故D错误.故选C.
