在温度为298K时,将0.10 mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g) 2NO2(g)的平衡。下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间)。
2NO2(g)的平衡。下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间)。
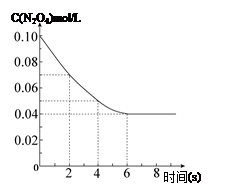
|
(3)在温度为298K时,达到平衡时四氧化二氮的转化率α1等于 。化学平衡常数为 。
(4)若在7s时向该密闭容器中再充入0.10 mol N2O4气体,此时平衡向 方向移动(填“正”或“逆”);再次达平衡时,总计0.20 mol N2O4的转化率为α2,正确的是 ( )
A.α2<α1 B.α2>α1 C.α2=α1 D.无法判断。
(5)下表是不同温度下测定的该反应的化学平衡常数。
| T/K | 310 | 320 |
| K值 | 0.38 | 0.42 |
据此判断该反应正反应是 反应(填“吸热”或“放热”)
(6)若其他条件不变,反应在398K条件下进行并达到平衡,此温度下N2O4的浓度随时间变化的曲线(以298K条件下进行并达到平衡的曲线作为参照)正确的是 ( )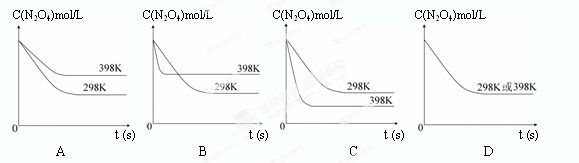
题目分析:(1)由图像可知2s至4s时间内N2O4的浓度变化为0.02 mol/L,根据v=△c/△t结合反应速率之比等于化学计量数之比计算可得,注意写清单位;
(2)对于一定条件下的可逆反应,无论反应从正向开始还是从逆向开始,只要最初加入的物质的量相当,就会达到同一平衡状态。由图像可知c(N2O4)的初始浓度为0.10mol/L,要达到同样的平衡状态,二氧化氮的起始浓度是0.20mol·L-1
(3)根据N2O4的起始浓度和转化浓度求出转化率;根据N2O4和NO2的平衡浓度和平衡常数表达式求平衡常数;
(4)对于一定条件下的可逆反应N2O4(g) 2NO2(g)达平衡后再充入0.10 mol N2O4气体,增大了反应物浓度平衡向正向移动;再加入N2O4后,平衡状态相当于增大压强,平衡左移,N2O4的转化率减小;
2NO2(g)达平衡后再充入0.10 mol N2O4气体,增大了反应物浓度平衡向正向移动;再加入N2O4后,平衡状态相当于增大压强,平衡左移,N2O4的转化率减小;
(5)由表中数据可知,温度升高,平衡常数增大,则说明升高温度,平衡向正反应方向移动,则正反应为吸热反应;
(6)可逆反应N2O4(g) 2NO2(g) 正反应为吸热反应,升温平衡向正向移动,N2O4的平衡浓度减小,升温反应速率加快,可缩短达平衡的时间,结合图像选C。
2NO2(g) 正反应为吸热反应,升温平衡向正向移动,N2O4的平衡浓度减小,升温反应速率加快,可缩短达平衡的时间,结合图像选C。
