某研究小组利用反应CO(g)+2H2O(g)⇌CO2(g)+H2(g)△H=-41.2kJ/mol,制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积之比混合时在合适条件下的反应情况.请回答下列问题:
(1)850℃时,向一体积为10L的恒容密闭容器中通入一定量的CO(g)和H2O(g),CO(g)和H2O(g)的浓度随时间变化的曲线如图所示,下列说法正确的是______(填序号).
A.达到平衡时,氢气的物质的量是0.12mol
B.达到平衡时,反应体系最终会放出49.44kJ热量
C.从第4min开始,混合气体的平均相对分子质量才不再变化
D.第6min时,若升高温度,该反应的化学平衡常数会减小
(2)850℃时,若向容积为2L的密闭容器中同时充入1.0mol CO、3.0mol H2O(g)、1.0mol CO2和x mol H2,要使上述反应开始时向正反应方向进行,则x应满足的条件是______.
(3)850℃时,若向容积为2L的密闭容器中同时充入1.0mol CO和2.0mol H2O(g),达 到平衡时,CO的转化率是______(小数点后保留1位有效数字).
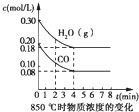
(1)A.由图可知,平衡时△c(CO)=0.2mol/L-0.08mol/L=0.12mol/L,浓度变化量之比等于化学计量数之比,故△c(H2)=△c(CO)=0.12mol/L,故n(H2)=0.12mol/L×10L=1.2mol,故A错误;
B.生成1.2mol氢气,通常条件下放出的热量为41.2kJ×
=49.44kJ,850℃时该反应的反应热△H≠-41.2kJ/mol,故B错误;1.2mol 1mol
C.由图可知4min时到达平衡,随反应进行,混合气体总质量不变,总物质的量减小,平均相对分子质量增大,平衡时混合气体的平均相对分子质量不变化,故C正确;
D.该反应正反应是放热反应,升高温度平衡向逆反应移动,平衡常数减小,故D正确;
故选CD.
(2)由图可知,平衡时CO的浓度为0.08mol/L,则:
CO(g)+H2O(g)⇌CO2(g)+H2(g)
开始(mol/L):0.2 0.3 0 0
变化(mol/L):0.12 0.12 0.12 0.12
变化(mol/L):0.08 0.18 0.12 0.12
故平衡常数k=
=1,0.12×0.12 0.08×0.18
平衡向正反应方向移动,浓度商小于平衡常数,即
<1,解得x<3,1×x 1×3
故答案为:x<3;
(3)令平衡时参加反应的CO为ymol,则:
CO(g)+H2O(g)⇌CO2(g)+H2(g)
开始(mol):1 2 0 0
变化(mol):y y y y
变化(mol):1-y 2-y y y
反应前后气体体积不变,故
=1,解得y=y×y (1-y)×(2-y)
mol,2 3
故CO的转化率为
×100%=66.7%,
mol2 3 1mol
故答案为:66.7%.
