工业制硝酸的主要反应是:4NH3(g)+5O2(g) 4NO(g)+6H2O (g) ΔH=" -1025" KJ/mol
4NO(g)+6H2O (g) ΔH=" -1025" KJ/mol
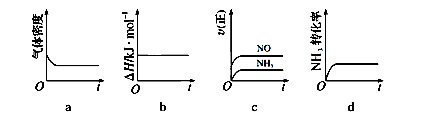
(1)一定温度下,现将0.8mol NH3和1.5mol O2充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是
(2)在容积为1L的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | 0.8 | 1.5 | 0 |
| 第2min | 0.7 | a | 0.1 |
| 第4min | 0.4 | 1.0 | 0.4 |
| 第6min | 0.4 | 1.0 | 0.4 |
| 第8min | 1.2 | 2.5 | 0.4 |
①起始时物料比c (O2) : c (NH3)>1.25,其原因是
②反应在第2min到第4min时O2的平均反应速率为 mol·L-1·min-1
③反应在第2min改变了反应条件,改变的条件可能是 (填字母序号)
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是 ,再次达到平衡时,NO的体积分数
(填“增大”、“减小”或“不变”)
(1)、ad (2)、①提高NH3转化率 ②0.1875 ③ab ④增加反应物浓度 减少
题目分析:(1)恒压条件,质量不变,密度不变,体积也不变,故平衡;转化率不变平衡,选a d
(2)①增大O2的浓度,提高NH3的转化率,③起始浓度没有变化,反应速率加快,故选ab④增加反应物的浓度,该反应特点为气体体积增大的反应,增大浓度相当于加压,故NO体积分数减少。

 ——范书义《近代中国的进步潮流》
——范书义《近代中国的进步潮流》