制取尿素[CO(NH2)2]的反应:2NH3(g)+CO2(g)  CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
某温度下体积为10L的密闭容器中,测得各物质的物质的量数据如下:
| 物质的量mol | 0min | 2 min | 3 min | 4 min |
| NH3 | 2.0 | 1.4 | n1 | n1 |
| CO2 | 1.0 | 0.7 | n2 | n2 |
| H2O | 0 | 0.3 | n3[ | n3 |
(1)根据表中数据计算0~2min内NH3的平均反应速率 ,若起始时与平衡时的气体总压强之比为15/11,n1= mol。
(2)该温度下此反应的平衡常数表达式为
(3)下列各项能表示该反应达到平衡状态是 。
A.消耗NH3的物质的量与生成H2O的物质的量之比为2∶1
B.c(NH3):c(CO2):c(H2O)=2∶1∶1
C.气体密度不再变化
D.容器压强不再变化
(1)0.03mol/(L·min)(2分);1.2(2分)(2)K=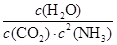 (2分)(3)CD(2分)
(2分)(3)CD(2分)
题目分析:(1)根据表中数据可知,0~2min内NH3的物质的量减少了2.0mol-1.4mol=0.6mol,其浓度变化量=0.6mol÷10L=0.06mol/L,所以氨气的平均反应速率=0.06mol/L÷2min=0.03mol/(L·min)。
2NH3(g)+CO2(g) 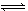 CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
起始量(mol) 2.0 1.0 0
变化量(mol) (2.0-n1) (1.0-0.5n1) (1.0-0.5n1)
平衡量(mol) n1 0.5 n1 (1.0-0.5n1)
则根据压强之比是相应气体的物质的量之比可知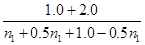 =
=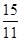
解得n1=1.2
(2)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的方程式可知,该反应的平衡常数表达式K=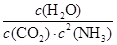 。
。
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A、反应速率之比等于相应的化学计量数之比,因此根据方程式可知,消耗NH3的物质的量与生成H2O的物质的量之比始终为2∶1,A不能说明反应达到平衡状态;B、平衡时浓度不再发生变化,但物质的浓度之间不一定相等或满足某种关系,因此c(NH3):c(CO2):c(H2O)=2∶1∶1不能说明反应达到平衡状态;C、密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但质量是减少的,因此当气体密度不再变化时可以说明反应达到平衡状态;D、该反应是气体体积减小的可逆反应,所以压强也是减小的,因此容器压强不再变化可以说明反应达到平衡状态,答案选CD。
