雷利是英国物理学家,他曾用下列两种方法测定氮气的密度.
方法一:将除去水蒸气和二氧化碳的空气通过烧红的装有铜屑的玻璃管,使空气中的氧气全部除去,测得氮气的密度为1.2572kg/L.
方法二:将氨气(NH3)通过赤热的装有氧化铜的玻璃管,生成铜、氮气和水蒸气,除去水蒸气后测得氮气的密度为1.2508g/L.
若两次测定的状况相同,请问:
(1)方法二中发生反应的化学方程式为______;
(2)欲除去空气中的二氧化碳,可供选择的装置(空气从左端导气管进入,右端导气管输出)如图所示,你选择的装置是______,瓶中发生反应的化学方程式为______.
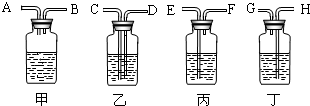
(3)请分析两种方法所测定的氮气密度数值不同的原因.
______
______.
(1)方法二:将氨气(NH3)通过赤热的装有氧化铜的玻璃管,生成铜、氮气和水蒸气,化学方程式为:
2NH3+3CuO
3Cu+3H2O+N2; △ .
(2)除去气体中杂质时,应使混合气体通过溶液,即长进短出,所以选择丙装置;二氧化碳能与氢氧化钠反应,所以除二氧化碳应通过过量的氢氧化钠溶液,发生的反应为:2NaOH+CO2=Na2CO3+H2O;
(3)雷利从空气中分离的氮气中含有少量稀有气体,该稀有气体的密度大于氮气,并不是纯净的氮气,19世纪末以前,人们就是认为空气由氧气和氮气组成,还没有发现其他气体,从含氮物质制得的氮气密度是纯氮气的密度,从空气中分离的氮气的密度实际上包括了稀有气体等杂质了,所以测得的氮气密度偏大.
故答案为:
(1)2NH3+3CuO
3Cu+3H2O+N2; △ .
(2)丙,2NaOH+CO2=Na2CO3+H2O;
(3)方法一中的“氮气”中含有少量的稀有气体,该稀有气体的密度大于氮气.
