问题
问答题
乙醇(C2H5OH)是以高梁、玉米、薯类等为原料,经过发酵、蒸馏制得,属于可再生资源.乙醇在足量的氧气中完全燃烧时生成二氧化碳和水,如果氧气不足,乙醇燃烧可能还有一氧化碳生成.现用下图实验装置进行实验,检验乙醇的燃烧产物中是否有二氧化碳和一氧化碳:(友情提示:CO+CuO
CO2+Cu) △ .
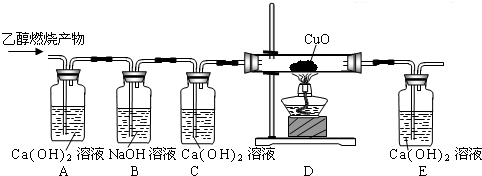
请回答下列问题:
(1)写出乙醇在足量的氧气中完全燃烧的化学方程式______.
(2)有甲、乙、丙三个同学分别完成上述实验并将观察到的现象填写在下表中,试用“有”、“没有”和“可能有”填写下表中的实验结论.
| 实验现象 | 实验结论 | ||||
| A装置 | C装置 | E装置 | 是否有二氧化碳 | 是否有一氧化碳 | |
| 甲同学 | 石灰水 变浑浊 | 石灰水 没变浑浊 | 石灰水 没变浑浊 | ||
| 乙同学 | 石灰水 变浑浊 | 石灰水 变浑浊 | 石灰水 变浑浊 | ||
| 丙同学 | 石灰水 没变浑浊 | 石灰水 没变浑浊 | 石灰水 变浑浊 | ||
答案
答:(1)乙醇(C2H5OH)在足量氧气中完全燃烧生成二氧化碳和水;
故选C2H5OH+3O2
2CO2+3H2O; 点燃 .
(2)装置A中石灰水变浑浊,可以说明燃烧生成二氧化碳;
装置C中石灰水不浑浊,说明混合气体中二氧化碳已完全吸收,变浑浊则说明前面生成的二氧化碳没有吸收完全,对后面二氧化碳的判断带来影响;
装置E中石灰水变浑浊,说明气体中有二氧化碳;
故答案为:
| 实验现象 | 实验结论 | ||||
| A装置 | C装置 | E装置 | 是否有二氧化碳 | 是否有一氧化碳 | |
| 甲同学 | 有 | 没有 | |||
| 乙同学 | 有 | 可能有 | |||
| 丙同学 | 没有 | 有 | |||
| 12 |
| 44 |
5.6g一氧化碳中C元素质量=5.6g×
×100%=2.4g12 28
则燃烧的乙醇中C元素质量=1.2g+2.4g=3.6g
乙醇中C、H元素质量比=24:6=4:1,则乙醇中H元素质量=
=0.9g3.6g 4
乙醇燃烧生成水的质量=0.9g÷
×100%=8.1g2 18
故答案为:8.1g.
