把大气中的游离态的氮转化为氮的化合物的过程称为固氮。生物固氮和大气固氮(闪电时N2转化为NO)属于自然固氮,这远不能满足人类的需要。工业固氮(合成氨)是目前人工固氮的主要方法。有关大气固氮和工业固氮的平衡常数K值分别如下表一和表二。
表一:N2+ O2 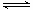 2NO
2NO
| 温度 | 27℃ | 2000℃ |
| K值 | 3.84×10-31 | 0.1 |
表二:N2+ 3H2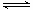 2NH3
2NH3
| 温度 | 25℃ | 350℃ | 400℃ | 450℃ |
| K值 | 5×108 | 1.847 | 0.507 | 0.152 |
A、N2+ O2 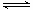 2NO是吸热反应
2NO是吸热反应
B、人类大规模模拟大气固氮是没有意义的
C、在常温下,增加工业固氮的容器的压强,K值会发生改变
D、工业固氮是放热反应
(2)向某密闭容器中加入4 mol NH3、1.2 mol H2和一定量的N2三种气体,一定条件下发生反应,各物质的浓度随时间变化如甲图所示[已知0~t1阶段保持恒温、恒容,且c(N2)未画出]。乙图为t2时刻后改变反应条件,反应速率随时间的变化情况,已知在t2、t3、t4、t5时刻各改变一种不同的条件。
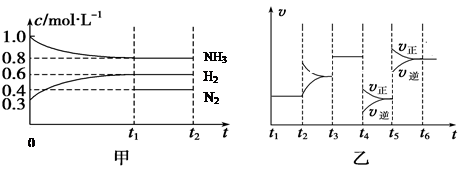
①若t1="15" s,则t0~t1阶段的反应速率为v(H2)=
②N2的起始物质的量为
③反应达到平衡状态,下列说法中能表明已达到平衡状态的是
A、单位时间内生成a molN2,同时生成3a mol H2 B、容器的总压强不再变化
C、混合气体的密度不再变化 D、三个H—H 键断裂的同时有六个H—N键断裂
④t4时刻改变的条件为 ,t5时刻改变的条件为
⑤已知t0~t1阶段该反应放出或吸收的热量为Q kJ(Q为正值),试写出该反应的热化学方程式:____________________________________________________________________
(1)ABD(2分)
(2)①0.02mol/(L·s) ②1.2mol (各1分) ③BD(2分) ④减小压强 升高 温度(各1分) ⑤2NH3(g) N2 (g)+ 3H2(g) △H=+2.5QkJ/mol(2分)
N2 (g)+ 3H2(g) △H=+2.5QkJ/mol(2分)
题目分析:(1)A、从表一可以看出,随着温度的升高,K值增大,表明正向是吸热的方向,正确;B、从表一数据还可以看出,即使是升高到2000℃ ,氮气与氧气生成一氧化氮的平衡常数也只达到0.1,但是对于人工合成氨来说,就是在25℃ ,其平衡常数也达到了5×108,表明人类大规模模拟大气固氮是没有意义的,这种说法正确;C、K值只随温度的改变而改变,不随压强的改变而改变,错误;D、从表二可以看出,温度越高,平衡常数越小,表明正向是一个放热的方向。正确。
(2)反应速率是指单位时间内浓度的改变量:①
②从图中可以计算出这容器的体积为:4L。
因为化学反应速率的比等化学计量数之比,因此: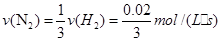
那么N2的起始物质的量为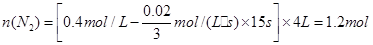
③A、单位时间内生成a molN2,同时生成3a mol H2,这种关系不管平衡与否,一直存在,不能作为达到平衡的标志,错误;B、氨气分解生成氮气和氢气,是一个体积增大的反应,当混合气体的总压强不再变化时,意味着反应的各物质的量已不再随时间的改变而改变,即达到平衡状态,正确;C、与B和道理一样,正确;D、三个H—H 键断裂的同时有六个H—N键断裂,这种关系是始终存在的,不管平衡与否。
④t4时刻正逆反应速率都减小,且逆反应速率减小的程度大,表明平衡正向移动,而正向是吸热和体积增大的方向,因此只能是减小压强;t5时刻正逆反应速率都增在,且正反应速率增大的程度大,表明平衡正向移动,而正向是吸热和体积增大的方向,因此只能是升高温度。
⑤2NH3(g)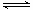 N2 (g)+ 3H2(g) △H=+2.5QkJ/mol(2分)。
N2 (g)+ 3H2(g) △H=+2.5QkJ/mol(2分)。

