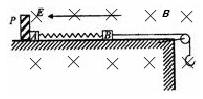
有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06 g Na2CO3和0.84 g NaHCO3,A、B中分别有10 mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中
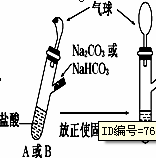
下列叙述正确的是
A.A装置的气球膨胀速率大
B.若最终两气球体积相同,则盐酸的浓度一定大于或等于2 mol/L
C.若最终两气球体积不同,则盐酸的浓度一定小于或等于1 mol/L
D.最终两试管中Na+、Cl-的物质的量一定相同
答案:B
A错,碳酸钠与盐酸反应先生成碳酸氢钠,而碳酸氢钠与盐酸反应立即有二氧化碳气体生成,所以,B装置的气球膨胀速率大;B正确,1.06 g Na2CO3的物质的量为0.01mol,完全反应需消耗HCL0.02mol,0.84 g NaHCO3的物质的量为0.01mol,完全反应需消耗HCL0.01mol,所以若最终两气球体积相同,则盐酸的浓度一定大于或等于2 mol/L;C错,若最终两气球体积不同,则盐酸的浓度一定小于2 mol/L;D错,因碳酸钠含钠的量为碳酸氢钠中钠的量的两倍,即,最终两溶液中Na+、Cl-的物质的量不相同;

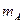 和
和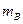 的小物块A和B(可视为质点)分别带有
的小物块A和B(可视为质点)分别带有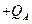 和
和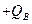 的电荷量,两物块由绝缘的轻弹簧相连,一不可伸长的轻绳跨过定滑轮,一端与物块B 连接,另一端连接轻质小钩。整个装置处于正交的场强大小为E、方向水平向左的匀强电场和磁感应强度大小为B 、方向水平向里的匀强磁场中。物块A,B 开始时均静止,已知弹簧的劲度系数为K,不计一切摩擦及AB间的库仑力,物块A、B所带的电荷量不变,B不会碰到滑轮,物块A、B均不离开水平桌面。若在小钩上挂一质量为M的物块C并由静止释放,可使物块A对挡板P的压力为零,但不会离开P,则
的电荷量,两物块由绝缘的轻弹簧相连,一不可伸长的轻绳跨过定滑轮,一端与物块B 连接,另一端连接轻质小钩。整个装置处于正交的场强大小为E、方向水平向左的匀强电场和磁感应强度大小为B 、方向水平向里的匀强磁场中。物块A,B 开始时均静止,已知弹簧的劲度系数为K,不计一切摩擦及AB间的库仑力,物块A、B所带的电荷量不变,B不会碰到滑轮,物块A、B均不离开水平桌面。若在小钩上挂一质量为M的物块C并由静止释放,可使物块A对挡板P的压力为零,但不会离开P,则