问题
问答题
如图,甲烧杯中盛有硫酸铜溶液,乙烧杯中盛有饱和氯化钠溶液.A、B、C、D均为石墨电极.如果电解过程中共有0.2mol电子转移,则:
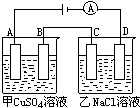
(1)甲烧杯中______极上最多可析出铜______g.A极电极反应______.
(2)乙烧杯中滴入酚酞试液______极附近先变红.乙烧杯中最后得到______溶液,此时需加入______L(标准状况)HCl,才能是溶液恢复原浓度.
答案
(1)甲烧杯中A极和电源正极相连是阳极,发生电极反应 4OH---4e=2H2O+O2↑,B极和电源负极相连是阴极,发生电极反应:Cu2++2e-→Cu,电解过程中共有0.2mol电子转移,则会析出0.1mol的金属铜,即6.4g,故答案为:B;6.4g;4OH---4e=2H2O+O2↑;
(2)乙烧杯中D电极和电源的负极相连是阴极,发生的电极反应为:2H++2e-→H2,该极附近氢离子浓度减小,氢氧根浓度增大,滴加酚酞会在该处变红,C即是阳极,电极反应为:2Cl-→2e-+Cl2↑,电解的实质相当于电解了氯化氢,当
电解过程中有0.2mol电子转移时,分别生成氯气和氢气0.1mol,相当于电解掉了0.2mol的氯化氢,即4.48L,故答案为:D;NaOH;4.48.
