(16分)某同学想通过下图装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物.
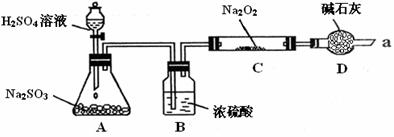
Ⅰ.装置B的作用 .
装置D的作用 .
Ⅱ.如何检验反应中是否有O2生成
.
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
假设3: .
(1)假设2的反应方程式为 .
(2)若Na2O2反应完全,为确定C中固体产物的成分,甲设计如下实验:

得出结论:产物是Na2SO4.
该方案是否合理 (填“是”或“否”),理由是 .
(3)设计实验验证假设3:取少量C中固体产物于试管中,加入适量的蒸馏水溶解, ,则假设3成立.
(16分)
Ⅰ.B:干燥SO2气体,防止较多的水蒸气与Na2O2反应…………(2分)
D:防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应;同时吸收过量的SO2,以免污染空气。…………………………………………………………………(2分)
Ⅱ.用带用火星的木条靠近干燥管口a,观察其是否燃烧。…………………(2分)
Ⅲ.有Na2SO3和Na2SO4 ……(1分)
(1)Na2O2 + SO2 = Na2SO4 ……(2分)
(2)否……(1分)
HNO3有氧化性,据此不能确定产物是Na2SO3还是Na2SO4或二者兼有。…(2分)
(3)先加入过量的稀盐酸,产生剌激性气味气体,再加入适量的BaCl2溶液,又产生白色沉淀。(或先加入过量BaCl2溶液,产生白色沉淀;再加入过量的稀盐酸,白色沉淀部分溶解,并产生剌激性气味气体。)……(试剂的选择和实验现象各2分共4分)
