(1)如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L。
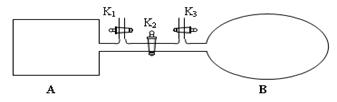
①B中可通过________________判断可逆反应2NO2 N2O4已经达到平衡。
N2O4已经达到平衡。
②若平衡后在A容器中再充入0.5mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数_______________(填 “变大”“变小”或“不变”)。
③若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)等于____________________。
④若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为______L。
(2)用电解的方法将硫化钠溶液氧化为多硫化物的研究具有重要的实际意义,将硫化物转变为多硫化物是电解法处理硫化氢废气的一个重要内容。
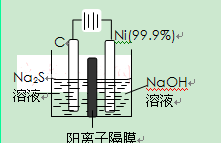
如图,是电解产生多硫化物的实验装置:
①已知阳极的反应为:(x+1)S2-=SxS2-+2xe-,
则阴极的电极反应式是: 。
当反应转移xmol电子时,产生的气体体积为 (标准状况下)。
②将Na2S·9H2O溶于水中配制硫化物溶液时,通常是在
氮气气氛下溶解。其原因是(用离子反应方程式表示): 。
(14分,每空2分)
(1))①气囊不再变小或颜色不再变化
②变小
③0.4/at(mol.L-1.s-1)
④0.7a
(2)①2H+ + 2e-=H2↑ 11.2x L
②2S2-+O2+2H2O=2S↓+4OH-
题目分析:(1)①气囊不再变小或颜色不再变化时,表示各物质的浓度不变,即反应已达到平衡。
②若平衡后在A容器中再充入0.5mol N2O4,容器内压强增大,增大压强平衡向气体物质的量减小的方向移动,所以平衡混合气中NO2的体积分数减小。
③运用三段式进行计算:设转化的NO2的物质的量为x,2NO2 N2O4
N2O4
初始物质的量(mol) 1 0
转化物质的量(mol) x x/2
平衡物质的量(mol) 1-x x/2
达到平衡后容器内压强为起始压强的0.8倍,则(1-x+x/2):1="0.8" 得x=0..4mol,则V(NO2)=0.4mol÷aL÷ts=0.4/at(mol.L-1.s-1)。
④打开K2,则相当于是在等温等压时的平衡,因此平衡是等效的,由于此时反应物的物质的量是B中的二倍,所以打开K2之前,气球B体积为(aL+0.4aL)÷2=0.7aL。
(2)①NaOH溶液中H2O电离出的H+在阴极上放电:2H+ + 2e-=H2↑;根据化合价的变化可知,H2与电子的对应关系为:H2 ~ 2e‾,V(H2)=xmol×1/2×22.4L/mol=11.2x L。
②在氮气气氛下溶解可防止S2‾被O2氧化,即防止2S2-+O2+2H2O=2S↓+4OH- 发生。
