硝酸工业的基础是氨的催化氧化,在催化剂作用下发生如下反应:
①4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=-905kJ/mol ①主反应
②4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g)△H=-1268kJ/mol ②副反应
有关物质产率与温度的关系如甲图.
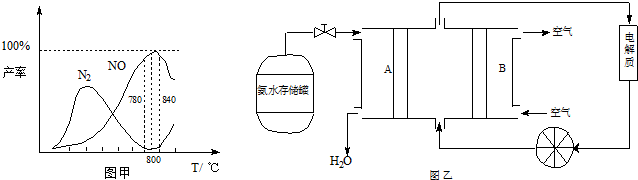
(1)由反应①②可知反应③N2(g)+O2(g)⇌2NO(g)的反应热△H=______
(2)由图甲可知工业上氨催化氧化生成 NO时,反应温度最好控制在______
(3)用Fe3O4制备Fe(NO3)3溶液时,需加过量的稀硝酸,原因一:将Fe4O3中的Fe2+全部转化为Fe3+,原因二:______(用文字和离子方程式说明).
(4)将NH3通入NaClO溶液中,可生成N2H4,则反应的离子方程式为______.
(5)依据反应②可以设计成直接供氨式碱性燃料电池(如乙图所示),则图中A为______(填“正极”或“负极”),电极方程式为______.
(1)由盖斯定律,(①-②)×
可得N2(g)+O2(g)⇌2NO(g),故△H=1 2
×[(-905kJ/mol)-(-1258kJ/mol)]=+181.5 kJ/mol,1 2
故答案为:+181.5 kJ/mol;
(2)从图象可以看在,反应温度在780~840℃,NO的产率最大,故选择780~840℃,
故答案为:780~840℃;
(3)溶液中铁离子水解Fe3++3H2O⇌Fe(OH)3+3H+,过量的硝酸抑制Fe3+的水解,
故答案为:溶液中铁离子水解Fe3++3H2O⇌Fe(OH)3+3H+,过量的硝酸抑制Fe3+的水解;
(4)NH3通入NaClO溶液中,生成N2H4,N元素的化合价升高,故Cl元素的化合价应降低,有氯离子生成,根据元素守恒与电荷守恒可知,还有水生成,配平后离子方程式为:2NH3+ClO-=N2H4+Cl-+H2O,
故答案为:2NH3+ClO-=N2H4+Cl-+H2O;
(5)由图可知,A极通入的为氨气,发生氧化反应,为负极,氨气在碱性条件下放电生成氮气与水,电极反应式为:2NH3-6e-+6OH-=N2+6H2O,
故答案为:负极;2NH3-6e-+6OH-=N2+6H2O.
