(10分)A-G的转化关系如图所示(部分反应物、产物和反应条件未标出)
已知:①A、B为中学化学常见的金属单质;C-G均为化合物,并且E和G均含有3种元素;②C是淡黄色固体,D既能与强酸溶液反应,又能与强碱溶液反应;③F溶液中加入AgNO3溶液产生不溶于稀硝酸的白色沉淀;④E和G焰色反应均呈黄色。
根据以上信息回答下列问题:
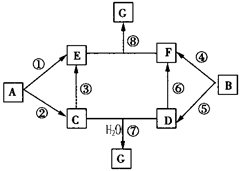
(1)写出物质G的化学式:
(2)①-⑥反应中,不属于氧化还原反应的是 ;
(3)反应③的离子方程式为 ;
(4)反应⑦对应的总化学方程式为 ;
(5)反应③中,若有31.2g C参加反应,转移电子的物质的量为 。
(10分)(1) 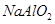
(2)⑥
(3)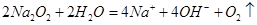
(4)2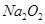 +2Al2O3===4
+2Al2O3===4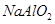 +O2↑
+O2↑
(5)0.4mol
无机推断重点是找到突破点
金属单质A、B可生成“淡黄色固体C”、“D既能与强酸溶液反应,又能与强碱溶液反应”,可猜定A、B分别为钠与铝,而C、D分别为Na2O2、Al2O3;
钠、Na2O2均可生成焰色反应呈黄色、含三种元素的E,可判定E为NaOH;
铝、Al2O3均可生成F,“F溶液中加入AgNO3溶液产生不溶于稀硝酸的白色沉淀”,也就是F含有氯元素,则可判定E为AlCl3;
NaOH与AlCl3生成的G物质含有三种元素,且焰色反应为黄色,即G为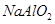
(2)涉及反应为①2Na+2H2O=2NaOH+H2↑ ②2Na+O2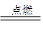 Na2O2 ③2Na2O2+2H2O=4NaOH+O2↑ ④2Al+6HCl=2AlCl3+3H2↑ ⑤4Al+3O2
Na2O2 ③2Na2O2+2H2O=4NaOH+O2↑ ④2Al+6HCl=2AlCl3+3H2↑ ⑤4Al+3O2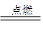 Al2O3 ⑥Al2O3+6HCl=2AlCl3+3H2O,其中只有反应⑥为非氧化还原反应
Al2O3 ⑥Al2O3+6HCl=2AlCl3+3H2O,其中只有反应⑥为非氧化还原反应
(4)2Na2O2+2H2O=4NaOH+O2↑ Al2O3+2NaOH=2NaAlO2+H2O,总反应为2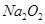 +2Al2O3===4
+2Al2O3===4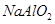 +O2↑
+O2↑
(5)反应③2Na2O2+2H2O=4NaOH+O2↑为自身氧化还原反应,反应中有2个电子转移,若有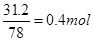 Na2O2参加反应,则转移的电子的物质的量为0.4mol
Na2O2参加反应,则转移的电子的物质的量为0.4mol
