(12分)NaCl是一种化工原料,可以制备一系列物质(反应条件、部分反应物质已略去),它们的转化关系如图所示,请回答下列问题:
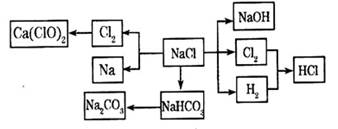
(1)工业上常用电解熔融NaCl的方法制取金属钠,NaCl熔化时破坏离子键的过程属于___________(填“物理变化”或“化学变化”)。
(2)写出工业上制取HCl的化学方程式________________________________________。
(3)写出工业上制取烧碱的离子方程式________________________________________。
(4)氨碱法制纯碱的工艺流程为:
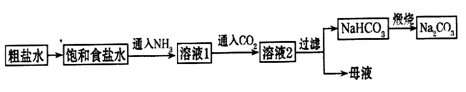
由NaHCO3制取Na2CO3的化学方程式________________________________________。
工艺流程中无向饱和食盐水中通入NH3(再通入CO2)的目的是:____________________
___________________________________________________________________________。
(5)请你设计一实验证明Na2CO3溶液碱性比NaHCO3溶液的碱性强:_________________
____________________________________________________________________________
(12分,每空2分)
(1)物理变化
(2)H2+Cl2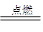 2HCl
2HCl
(3)2Cl-+2H2O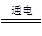 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
(4)2NaHCO3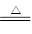 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
因为NH3极易溶于水且溶液呈弱减性,再通入CO2使之更多地转化为HCO3-
(5)配制 0.1mol·L—1(或等物质的量浓度)的两种溶液,测其pH,Na2CO3溶液pH大于NaHCO3溶液,说明Na2CO3溶液碱性比NaHCO3溶液的碱性强(或其它合理答案)
(1)NaCl熔化时离子键被破坏,但没有生成新键,不属于化学过程,为物理变化
(2)工业上一般采用氢气与氯气中燃烧制取HCl:H2+Cl2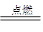 2HCl
2HCl
(3)工业上一般采用电解食盐水的方法来制取烧碱:2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
(4)2NaHCO3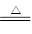 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
因为NH3极易溶于水且溶液呈弱减性,再通入CO2使之更多地转化为HCO3-
(5)在相同浓度的情况下测两溶液的pH即可
