(16分)某小组的同学对放置已久的过氧化钠的成份进行探究,请回答下列问题:
(1)反应 2Na2O2+2H2O=4NaOH+O2↑的还原剂是 (写化学式);
反应2Na2O2+2CO2=2Na2CO3+O2↑中,每生成1molO2则转移了 mol电子。
(2)进行探究:
①提出假设。假设1:全部是Na2O2 假设2:全部是Na2CO3
假设3:
②设计方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论(可不填满)。限选实验试剂和仪器:蒸馏水、1moL L-1H2SO4、澄清石灰水、淀粉-KI溶液、酚酞溶液、火柴、试管、小烧杯。
L-1H2SO4、澄清石灰水、淀粉-KI溶液、酚酞溶液、火柴、试管、小烧杯。
| 实验步骤 | 预期现象和结论 |
步骤1:取少量固体样品于试管中,滴加足量1moL L-1 H2SO4至固体溶解,然后将内壁附有澄清石灰水的烧杯罩于试管口。 L-1 H2SO4至固体溶解,然后将内壁附有澄清石灰水的烧杯罩于试管口。 | 若澄清石灰水未见浑浊,则假设1成立; 若澄清石灰水变浑浊,则
|
| 步骤2: | |
| 步骤3: |
(16分)(1)(4分)Na2O2 2
(2)①(2分)假设3:是Na2O2与Na2CO3的混合物 [说明:不可能有NaOH,因为在空气中即使吸水生成有NaOH,但时间长了也与CO2反应生成了Na2CO3]
②
| 实验步骤 | 预期现象和结论 |
| 假设2或假设3成立(2分,或假设1不成立) | |
| 步骤2:另取少量固体于试管中加适量蒸馏水(2分),再滴入酚酞溶液(2分)[或,用带火星的火柴伸入试管口] [如果向步骤一的溶液中直接滴酚酞,或用KI淀粉液,扣1分] | 若滴入酚酞溶液后先变红后褪色(或溶液变蓝色,2分)[或带火星的火柴复燃],则假设1或假设3成立(1分);若红色不褪色,则假设2成立(1分) |
(1)反应中的电子转移为: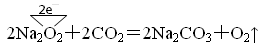 ,是Na2O2发生了自身氧化还原反应,既是氧化剂又是还原剂,每生成每生成1molO2则转移了2mol电子
,是Na2O2发生了自身氧化还原反应,既是氧化剂又是还原剂,每生成每生成1molO2则转移了2mol电子
(2)①Na2O2在空气中主要是可以和CO2、H2O反应分别生成Na2CO3与NaOH,而因为NaOH在空气中与CO2反应最终也生成Na2CO3,所以不可能有NaOH,故有三种假设情况
②实际上就是CO32—及Na2O2的检验。
