(9分)10 mL含有a mol HCl的稀盐酸和10 mL含有b molNa2CO3的稀溶液,按下图方式分别缓慢向对方溶液中滴加,并不断摇动试管,试分析下表并完成各题:(题中气体体积均在标准状况下测定,且不考虑气体在水中的溶解)
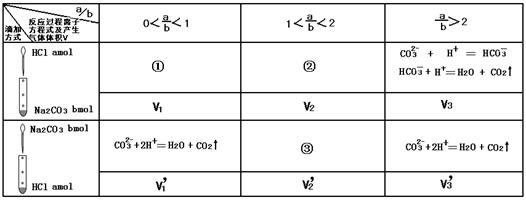
(1)表中对应过程的离子反应方程式:
① ;③ 。
(2)上述所测六种情况下气体体积V1、V1'、V2、V2'、V3、V3'中为0的有 。
(3)V3与V3'的大小关系为V3 V3'(用“<” 、“>” 或“=”填空)
(4)若a=0.01,b=0.008,则V2= mL、V2'= mL。
(1)①CO32-+H+ = HCO3-(1分) ③CO32-+2H+ = CO2↑+H2O(1分)
(2)V1(1分) (3)=(2分) (4)V2=44.8mL(2分)、V2'=112mL(2分)
(1)碳酸钠和盐酸的反应是分步进行的,所以①、③的离子方程式是CO32-+H+ = HCO3-。反应③中盐酸是过量的,所以反应的离子方程式是CO32-+2H+ = CO2↑+H2O。
(2)由于碳酸钠和盐酸反应是分步进行的,所以若a小于b,则V1=0,其余都不是0。
(3)由于a大于2b,所以不论怎么滴加,生成的CO2都是相同的,即V3=V3'。
(4)若a=0.01,b=0.008,则根据方程式CO32-+H+ = HCO3-、HCO3-+H+ = CO2↑+H2O可知在反应②中生成的CO2是(0.01-0.008)mol=0.002mol,标准状况下的体积是44.8ml;而在反应③中根据方程式CO32-+2H+ = CO2↑+H2O可知,生成的CO2是0.01mol÷2=0.005mol,所以标准状况下的体积是0.005mol×22.4L/mol=0.112L=112ml。
