甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验。
(1)甲组:沉淀分析法:
把一定量的混合物溶解后加入过量CaCl2,然后将所得沉淀过滤、洗涤、烘干、称量。确定CaCl2溶液是否过量的方法是 洗涤沉淀并判断沉淀是否洗净的操作是_______________________________________。
(2)乙组:气体分析法:
把一定量的混合物与足量盐酸反应后,用如图装置测定产生的CO2气体的体积,为减小CO2的溶解,B中溶液应是____________,选用该溶液后实验结果还是不准确,原因是_________________。
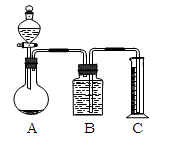
(3)请你设计一个与甲、乙两组操作不同的实验方案,测定混合
物中Na2CO3的含量。
方法: ;
试剂:_________________________________________________________________。
用到的玻璃仪器:_______________________________________________(至少2件)。
(1)静置,向上层清液中继续滴加CaCl2溶液,若无沉淀说明CaCl2已过量;
沿玻棒向过滤器中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复2~3次,然后向滤液(洗涤液)中滴加AgNO3溶液判断是否洗净。
(2)饱和NaHCO3溶液;从A出来的气体中混有HCl,会与NaHCO3反应生成CO2
(3)滴定分析法(或中和滴定法、滴定法、用标准盐酸滴定一定量的混合物等) 标准盐酸溶液、指示剂(甲基橙、酚酞) ; 酸式滴定管、锥形瓶、烧杯
题目分析:(1)确定CaCl2溶液是否过量的方法是继续滴加沉淀剂,所以正确的操作是静置,向上层清液中继续滴加CaCl2溶液,若无沉淀说明CaCl2已过量;洗涤沉淀需要在过滤器中洗涤,即沿玻棒向过滤器中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复2~3次。由于洗涤液中含有氯离子,则判断沉淀是否洗净的操作是向滤液(洗涤液)中滴加AgNO3溶液判断是否洗净。
(2)要减少CO2的溶解,则应该用饱和的碳酸氢钠溶液。由于盐酸以挥发,则生成的CO2中含有氯化氢,而HCl会与NaHCO3反应生成CO2,从而导致实验结果不准确。
(3)由于碳酸钠能和盐酸反应,所以也可以依据中和滴定实验原理进行测定。所用试剂是标准盐酸溶液、指示剂(甲基橙、酚酞);仪器是酸式滴定管、锥形瓶、烧杯。
点评:该题是高考中的常见题型,属于中等难度的试题,侧重对学生实验能力的培养,有利于调动学生的学习兴趣,激发学生的学习积极性,也有助于培养学生的规范实验设计能力。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。


