甲、乙、丙三位同学,分别在相同条件下用乙酸与乙醇反应来制取乙酸乙酯,但未用饱和Na2CO3溶液来吸收。
(1)甲、乙、丙同学将得到的酯提纯,在未用指示剂的情况下,他们都先加NaOH中和
过量的酸,然后用蒸馏法将酯分离出来。但得到的结果却不同:①甲得到了不溶于水
的中性酯;②乙得到显酸性的酯;③丙得到大量水溶性物质。试分析产生上述各种现
象的原因。
(2)丁同学为了进一步找出原因,将所得产物进行了分离探究,他的实验操作步骤流程
如下图。请你帮他完成该实验并填写下列空白。
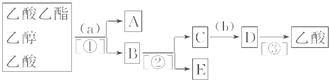
分离出的物质名称:A ,B ,
C ,D ,E ;
选择的试剂:a ,b ;
分离物质的方法:① ,② ,③ 。
(1)①甲同学加入的碱正好将过量的酸中和,所以蒸馏后得到中性酯;②乙同学
加入碱量不足,所以蒸馏出的产物中含过量的酸,得到显酸性的酯;③丙同学加入的
碱过量使生成的酯完全水解为可溶性的醇和钠盐
(2)A.乙酸乙酯 B.乙醇、乙酸钠 C.乙酸钠 D.乙酸、硫酸钠 E.乙醇
a.饱和碳酸钠溶液 b.硫酸
①分液 ②蒸馏 ③蒸馏
题目分析:(1)3人得到的酯的酸碱性不同,只能是加入的氢氧化钠的量不同,导致得到的酯的酸碱性不同。①甲同学加入的碱正好将过量的酸中和,所以蒸馏后得到中性酯;②乙同学加入碱量不足,所以蒸馏出的产物中含过量的酸,得到显酸性的酯;③丙同学加入的碱过量使生成的酯完全水解为可溶性的醇和钠盐;
(2)根据乙酸乙酯在饱和碳酸钠溶液中的溶解度最小,乙醇、乙酸易溶于饱和碳酸钠溶液,乙酸乙酯不溶于碳酸钠溶液,所以a是饱和碳酸钠溶液,A是乙酸乙酯,①是分液;由图判断E是乙醇,乙醇溶于饱和碳酸钠溶液中,乙酸与饱和碳酸钠溶液反应生成乙酸钠,所以分离方法②是蒸馏;则C是乙酸钠,乙酸钠转化为乙酸需要加入比乙酸酸性强的酸,但同时该酸的沸点不能很低,所以选择加入b是硫酸,生成的乙酸用③蒸馏的方法分离出来。
