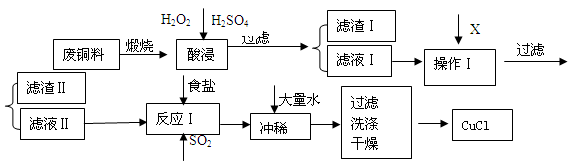
(14分) CuCl是有机合成的重要催化剂,并用于颜料、防腐等工业。工业上由废铜料(含Fe、Al及其化合物、SiO2杂质),生产CuCl的工艺流程如下:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 5.6 | 6.7 |
| Al(OH)3 | 3.8 | 4.7 |
已知:CuCl溶于NaCl的浓溶液可生成CuCl2-,CuCl2-的溶液用水稀释后可生成CuCl沉淀。
(1)煅烧的主要目的是: 。
(2)操作Ⅰ为调节溶液的PH值,范围为 ,加入的物质X可以是( )
A、CuO B、Cu(OH)2 C、NaOH 溶液 D、CaCO3
(3)滤渣Ⅱ的主要成分是 。
(4)往滤液Ⅱ中加入食盐并通入SO2可生成CuCl2-,请写出反应的离子方程式: 。
(5)在反应Ⅰ中,温度控制在70~80℃并使用浓NaCl溶液,主要目的是: 。
(6)常温下,已知CuOH的KSP为1.0×10-14,则Cu++H2O  CuOH + H+的平衡常数为: 。
CuOH + H+的平衡常数为: 。
(1)使铜转化为可溶于酸的氧化物 (2)4.7≤PH<5.6 ABC(3)Fe(OH)3 和Al(OH)3
(4)2H2O+2Cu2++SO2+4Cl-="2" CuCl2-+ SO42-+4H+ (5)提高的CuCl2—生成速率 (6)1
题目分析:(1)煅烧的主要目的是使铜转化为可溶于酸的氧化物。(2)操作Ⅰ为调节溶液的PH值,要想溶液中加入的物质消耗H+,同时不引入新的杂质离子,对后边的形成CuCl沉淀有利的物质,应该是CuO、Cu(OH)2、NaOH 溶液。因此选项为A、B、C。调整溶液的pH的范围应该是使杂质离子形成沉淀除去而Cu2+留在溶液中,根据表格提供的数据,应该在4.7~5.6。(3)此时产生的滤渣Ⅱ的主要成分是Fe(OH)3 和Al(OH)3;(4)往滤液Ⅱ中加入食盐并通入SO2发生氧化反应反应,可生成CuCl2-,该反应的离子方程式是2H2O+2Cu2++SO2+4Cl-="2" CuCl2-+ SO42-+4H+;(5)在反应Ⅰ中,温度控制在70~80℃并使用浓NaCl溶液,主要目的是提高的CuCl2—生成速率;(6)因为在常温下,已知CuOH的KSP为1.0×10-14,所以c(Cu+)=1.0×10-14÷10-7=10-7mol/L;Cu++H2O  CuOH + H+的平衡常数为
CuOH + H+的平衡常数为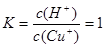 .
.
