(12分)NaHCO3和Na2CO3·xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量)。
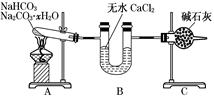
(1)A装置的作用是____________________________。
(2)B装置的作用是____________________________。
(3)C装置的作用是____________________________。
(4)若在装置A的试管中装入NaHCO3和Na2CO3·xH2O的混合物3.7 g,用酒精灯加热到反应完全,此时B管增重1.89 g,C管增重0.22 g,则x的值为 。
(5)该装置还不是很完善,可能使测定结果偏小,应如何改进________。为什么?
(1)加热,使NaHCO3分解,使Na2CO3·xH2O失水
(2)吸收反应中生成的水 (3)吸收反应中生成的CO2
(4)10
(5)在C装置后再加一个装有碱石灰的U形管
为了防止空气中的CO2和H2O被C装置中的碱石灰吸收
题目分析:从该实验的目的和要求来看:(1)A装置的作用是加热,使NaHCO3分解,使Na2CO3·xH2O失水。(2)B装置的作用是吸收反应中生成的水。(3)C装置的作用是吸收反应中生成的CO2。
(4)若在装置A的试管中装入NaHCO3和Na2CO3·xH2O的混合物3.7 g,用酒精灯加热到反应完全,此时B管增重1.89 g,C管增重0.22 g,从A,B,C,的作用可以看到:A的试管中装入NaHCO3和Na2CO3·xH2O的混合物总质量3.7 g,B管增重1.89 g,包括NaHCO3分解产生的水,和Na2CO3·xH2O失去的水,C管增重0.22 g,仅仅是碳酸氢钠分解产生的二氧化碳,由定量关系可知:2NaHCO3=Na2CO3+H2O +CO2↑ ,碳酸氢钠分解产生的二氧化和水的物质的量是相同的。所以计算关系如下:
2NaHCO3 = Na2CO3 + H2O + CO2↑
168 1 18 44
Z=0.84g Y="0.09" g 0.22 g
所以Na2CO3·xH2O的质量是3.7 g-0.84g=2.86g ,
所以Na2CO3·xH2O中的水的质量是1.89g-0.09g=1.8g
所以x的值为10。
(5)该装置还不是很完善,可能使测定结果偏小,应在C装置后再加一个装有碱石灰的U形管
为了防止空气中的CO2和H2O被C装置中的碱石灰吸收。
点评:熟悉碳酸氢钠和碳酸钠的性质此类问题不难解决。
碳酸氢钠的化学性质
1.与酸反应
与HCl反应:NaHCO₃+HCl ="===" NaCl+ H₂O+ CO₂↑
与CH₃COOH反应:NaHCO₃+CH₃COOH====CH₃COONa+H₂O+CO₂↑
2.与碱反应
与氢氧化钠反应:NaHCO₃+NaOH="===" Na2CO₃+ H2O
与氢氧化钙反应:要分过量和少量。
少量:NaHCO₃+ Ca(OH)₂="===" CaCO₃+ NaOH + H₂O过量:2NaHCO₃+ Ca(OH)₂="===" Na2CO₃+ CaCO₃↓+ 2H₂O
3.加热
受热分解:2NaHCO₃==△="=" Na₂CO₃+ H₂O + CO₂↑
4.电离
碳酸氢钠电离方程式 NaHCO₃="Na+" + HCO3﹣。
碳酸钠的化学性质
1 风化
碳酸钠的结晶水合物石碱(Na2CO3·10H2O)在干燥的空气中易风化。
Na2CO3·10H2O====Na2CO3+10H2O
2 与酸反应
Na2CO3+ 2HCl(过量) ="===" 2NaCl +H2CO3
碳酸不稳定,分解成二氧化碳和水
H2CO3====H2O + CO2↑
Na2CO3+ HCl(少量) ="===" NaCl + NaHCO3
3 与碱反应
Na2CO3+ Ca(OH)2="===" 2NaOH + CaCO3↓(碳酸钙白色沉淀,难溶于水,但可溶于酸)
4 与盐反应
Na2CO3+ BaCl2="===" 2NaCl + BaCO3↓(碳酸钡白色沉淀,难溶于水,但可溶于酸)
3Na2CO3+ Al2(SO4)3+ 3H2O ="===" 2Al(OH)3↓+ 3Na2SO4+ 3CO2↑
(氢氧化铝白色沉淀,难溶于水,可溶于酸、碱)
Na2CO3+CaCl2=====2NaCl+CaCO3↓
5 与H2O、CO2反应
Na2CO3+ H2O + CO2="===" 2NaHCO3(于碱性环境中沉淀析出)