问题
计算题
称取纯Na2CO3 0.53g,用未知浓度的盐酸滴定,恰好完全反应时,用去10mL盐酸。取此盐酸20mL(稀释到200mL)做如下实验:称取工业烧碱6.25g加水溶解至1L,用上述稀释后的盐酸滴定,达到终点时,稀盐酸和烧碱溶液的体积比为3:2,求工业烧碱的纯度。
答案
解:设盐酸的浓度为c
2×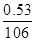 =c×10×10-3
=c×10×10-3
c=1mol/L (2分)
则稀盐酸浓度为c’=0.1mol/L
设烧碱纯度为x
0.1×3=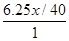 ×2
×2
x=96% (5分)
答:工业烧碱的纯度为96%
题目分析:设盐酸的浓度为c
2×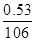 =c×10×10-3
=c×10×10-3
c=1mol/L (2分)
则稀盐酸浓度为c’=0.1mol/L
设烧碱纯度为x
0.1×3=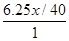 ×2
×2
x=96% (5分)
答:工业烧碱的纯度为96%
点评:解答关于化学计算的题目,学生一定要抓住实质,此题便不难解决。
