(14分)
氢溴酸在工业和医药领域中有着广泛的用途,下图是某兴趣小组模拟工厂制备氢溴酸粗品并精制的流程如下:
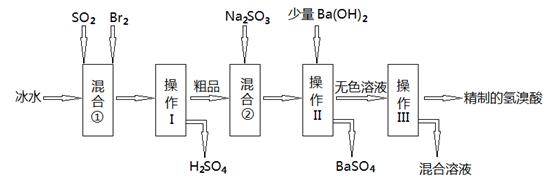
(1)混合①使用冰水的目的是 ;
(2)操作II和III的名称是 , ;
(3)混合②中发生反应的离子方程式为 ;
(4)工业上用氢溴酸和大理石制得溴化钙中含有少量Al3+、Fe3+杂质,加入适量的试剂 (填化学式)后控制溶液的PH约为8.0即可除去杂质,控制溶液的PH约为8.0的目的是_______________________________________________________;
(5)t℃时,将HBr通入AgNO3溶液中生成的AgBr在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgCl的Ksp=4×l0-10,下列说法不正确的是 ( )

A.向含有Cl-和Br- 的混合液中滴加硝酸银溶液,一定先产生AgBr的沉淀
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数Κ≈816
AgBr(s)+Cl-(aq)平衡常数Κ≈816
(每空2分)
(1)降低体系的温度,防止溴的挥发(2分)
(2)过滤,蒸馏(各2分)
(3) Br2+SO32-+H2O=2Br-+SO42-+2H+(2分)
(4) CaO或Ca(OH)2或CaCO3,确保Fe3+和Al3+沉淀完全和防止氢氧化铝溶解(各2分)
(5)AB(2分)
题目分析:(1)Br2氧化SO2放出很多热量,溴易挥发,使用冰水,降低体系温度,防止溴蒸发,使反应完全。
(2)由工艺流程可知,操作Ⅱ分离固体与液体,应是过滤;操作Ⅲ为互溶的溶液组分的分离,应是蒸馏。
(3)混合②中加入Na2SO3,Na2SO3具有还原性,被Br2氧化,所以离子方程式为:Br2+SO32-+H2O=2Br-+SO42-+2H+
(4)目的是制取CaBr2,通过控制溶液的PH约为8.0即可除去杂质Al3+、Fe3+,为了防止新杂质的进入,应加入含Ca元素且能与H+反应的物质,如CaO或Ca(OH)2或CaCO3;控制溶液的PH约为8.0时,Al3+、Fe3+转为Al(OH)3和Fe(OH)3沉淀而除去,所以控制溶液的PH约为8.0的目的是确保Fe3+和Al3+沉淀完全和防止氢氧化铝溶解。
(5)A、根据图中c点坐标可求出AgBr的Ksp=7×10-7×7×10-7= 4.9×10-13,小于AgCl的Ksp,但选项中没有给出Cl‾和Br‾浓度,所以不一定先产生AgBr的沉淀,错误;B、在AgBr饱和溶液中加入NaBr固体,沉淀溶解平衡移动后溶液仍为饱和溶液,不可能由c点到b点,错误;C、a点在溶解平衡曲线以下,所以a点对应的是AgBr的不饱和溶液,正确;D、在t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数Κ=c(Cl‾)/c(Br‾)= c(Cl‾)•c(Ag+)/c(Br‾) •c(Ag+)="Ksp(AgCl)/" Ksp(AgBr)= 4×l0-10/4.9×10-13≈816,正确。
AgBr(s)+Cl-(aq)平衡常数Κ=c(Cl‾)/c(Br‾)= c(Cl‾)•c(Ag+)/c(Br‾) •c(Ag+)="Ksp(AgCl)/" Ksp(AgBr)= 4×l0-10/4.9×10-13≈816,正确。
