(10分)现有一定量含有Na2O杂质的Na2O2试样,用下图所示的实验装置测定Na2O2试样的纯度。(可供选用的试剂只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水)
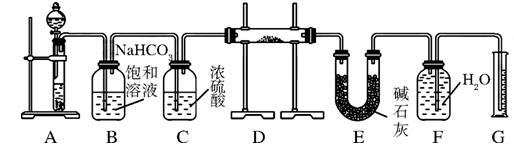
回答下列问题:
(1)装置A中液体试剂选用____________,理由是__________________________。
(2)装置B的作用是___________________,装置E中碱石灰的作用是___________。
(3)装置D中发生反应的化学方程式是:____________________、_______________________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为______。
(1)6 mol/L盐酸(2分) 硫酸与CaCO3固体反应生成的CaSO4微溶于水,会覆盖在CaCO3固体表面,使反应不能持续(2分)
(2)除去气体中的HCl(2分) 吸收装置D中反应剩余的CO2(2分)
(3)2Na2O2+2CO2=2Na2CO3+O2(2分)、Na2O+CO2=Na2CO3(2分)
(4)78%(2分)
题目分析:(1)装置A是碳酸钙和盐酸反应生成二氧化碳,碳酸钙和硫酸反应时,生成的硫酸钙是微溶于水的,会覆盖在碳酸钙的表面,使反应不能持续,所以用盐酸而不用硫酸来反应,
故答案为:6mol/L盐酸,硫酸和碳酸钙反应生成的硫酸钙是微溶于水的,会覆盖在碳酸钙的表面,使反应不能持续;
(2)碳酸钙和盐酸反应生成的二氧化碳气体中含有氯化氢气体,可以用饱和碳酸氢钠来除去,浓硫酸具有吸水性,可以将二氧化碳干燥,装置E中碱石灰的作用是吸收二氧化碳,防止对氧气的体积测量造成干扰,
故答案为:除去气体中的HCl;吸收装置D中反应剩余的二氧化碳;
(3)氧化钠和过氧化钠和二氧化碳反应的原理方程式分别为:2Na2O2+2CO2=2Na2CO3+O2,Na2O+CO2=Na2CO3,
故答案为:2Na2O2+2CO2=2Na2CO3+O2,Na2O+CO2=Na2CO3;
(4)根据反应2Na2O2+2CO2=2Na2CO3+O2,反应结束后测得气体体积为224mL(标准状况),即生成的氧气的量0.01mol,过氧化钠的物质的量为0.02ml,
过氧化钠的纯度= 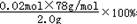 =78%,故答案为:78%.
=78%,故答案为:78%.
点评:本题考查学生过氧化钠的化学性质知识,通过实验方式考查增加了难度,综合性较强。
