我们已经知道,空气的主要成分是氮气和氧气,下图是测定空气中氧气含量的实验装置,试回答下列问题.
(1)实验过程中,燃烧匙里为什么要盛放过量的红磷?______.
(2)观察到的实验现象是______.写出反应的化学反应式______.
(3)这个实验除了可以得出氧气约占空气的1/5的结论外,还可以推论出氮气______(填“易”或“难”)溶于水和其化学性质______(填“活泼”或“不活泼”)的结论.
(4)在此实验过程中能否用碳、硫代替红磷?______.
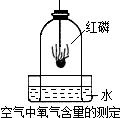
(1)为了使集气内的氧气完全消耗完在做实验时红磷要过量;
(2)红磷产生大量白烟,放出热量,消耗了空气中的氧气使集气瓶内的压强减小,水面上升至原容积的1/5;反应的化学方程式为:4P+5O2
2P2O5 点燃 .
(3)因为剩余气体主要是氮气,所以得出氮气难溶于水的物理性质,同时,它不燃烧也不支持燃烧,化学性质不活泼.
(4)测定空气中氧气的体积分数利用的是压强的改变,所以若把红磷换成木炭或硫,木炭、硫和氧气反应又生成气体,没有改变集气瓶内的压强,达不到实验目的.
故答案为:
(1)盛放过量红磷的目的是让氧气尽量消耗完,使测得的氧气的体积更接近空气中氧气的实际体积.
(2)产生大量白烟,放出热量,冷却后,水面上升至原容积的1/5.4P+5O2
2P2O5 点燃 .
(3)难,不活泼.
(4)不能用碳、硫代替红磷,因为它们的生成物均为气体.

