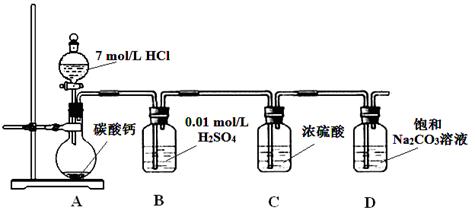
某实验小组把CO2通入饱和Na2CO3溶液制取NaHCO3,装置如图所示(气密性已检验,部分夹持装置略):
(1)D中产生NaHCO3的化学方程式是 。
(2)请结合化学平衡移动原理解释B中溶液的作用 。
(3)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤、干燥备用。为确定固体的成分,实验小组设计方案如下(称取一定质量的固体,配成1000 mL溶液作为样液,其余固体备用):
① 方案1:取样液与澄清的Ca(OH)2溶液混合,出现白色沉淀。
实验小组对现象产生的原理进行分析,认为该方案不合理,理由是 。
② 方案2:取样液与BaCl2溶液混合,出现白色沉淀并有气体产生。
实验小组认为固体中存在NaHCO3,其离子方程式是 。
该小组认为不能确定是否存在Na2CO3,你认为该结论是否合理?_____。
③ 方案3:实验小组中甲、乙同学利用NaHCO3的不稳定性进行如下实验:
甲同学:取样液400 mL,用pH计测溶液pH,再水浴加热蒸发至200 mL,接下来的操作是 ,结果表明白色固体中存在NaHCO3。为进一步证明白色固体是否为纯净的NaHCO3,结合甲同学实验,还应补充的实验是 。
乙同学:利用仪器测定了固体残留率随温度变化的曲线,如下图所示。
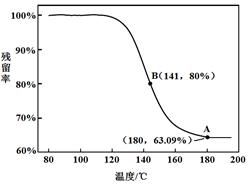
a. 根据A点坐标得到的结论是 。
b. 根据B点坐标,计算残留固体中n(NaHCO3:n(Na2CO3))= 。
通过上述实验,该小组认为,可以向饱和Na2CO3溶液中通入过量CO2制备NaHCO3。
(1)Na2CO3+CO2+H2O = 2NaHCO3 (2分)
(2)CO2在水中存在平衡:CO2+H2O H2CO3
H2CO3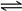 HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体(2分)
HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体(2分)
(3)① Na2CO3和NaHCO3都能跟Ca(OH)2溶液发生反应生成白色沉淀,无法确定固体的成分中是否含有NaHCO3。(2分)
② 2HCO3-+Ba2+=BaCO3↓+ CO2↑+H2O(2分)
合理(1分)
③ 接下来的操作:冷却到室温,加水至溶液体积为400 mL,再次测定pH(2分)
补充实验:取相同质量的纯净的NaHCO3配成1000 mL溶液,取400 mL,重复甲的实验,进行对照。(2分)
a.白色固体为NaHCO3(2分)
b.71:42(或1.69)(1分)
题目分析: A装置中反应制备CO2,其中有杂质HCl、H2O(g),B装置既减少CO2的溶解,又能吸收HCl,C装置干燥CO2,D装置制备碳酸氢钠。(3)Na2CO3和NaHCO3都能和Ca(OH)2反应生成白色沉淀,方案1不合理,方案2 Na2CO3和BaCl2反应有白色沉淀,NaHCO3和BaCl2反应有白色沉淀和气体,因此可以确定NaHCO3存在,但不能确定Na2CO3的存在。方案3 Na2CO3和NaHCO3溶液都显碱性,但水解程度不同,可通过比较PH值前后大小进行区别。乙同学在温度为180时,残留率正好符合NaHCO3完全分解的计算,B点根据差量法进行计算,设原来有100克NaHCO3,反应后剩余80克,减少20克是CO2和H2O的质量,列方程组计算。
