(12分)某湖泊底部为石灰石(CaCO3)质,假设湖水中只溶有少量CO2。
⑴写出CaCO3的溶解平衡平衡表达式: 。
⑵当大气中CO2含量升高时,CaCO3可能发生的变化是 (用化学方程式表示)。

| 实验编号 | c(NaOH)mol/L | V(NaOH)mL | V(强酸)mL |
| 1 | 0.1154 | 25.72 | 25.09 |
| 2 | 0.1154 | 26.70 | 25.00 |
| 3 | 0.1154 | 26.79 | 25.09 |
| 4 | 0.1154 | 26.71 | 25.00 |
(12分)
(1)CaCO3(s)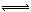 Ca2+(aq)+CO32‾(ag)
Ca2+(aq)+CO32‾(ag)
(2)CaCO3+H2O+CO2=Ca(HCO3)2
(3)2CaCO3+H2O+SO2=Ca(HCO3)2+CaSO3
(4)Al(OH)3,在弱酸性条件下氧化铝溶解为铝离子,Al3++3H2O 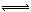 Al(OH)3+3H+,氢氧化铝沉积在鱼鳃表面形成粘膜。
Al(OH)3+3H+,氢氧化铝沉积在鱼鳃表面形成粘膜。
(5)0.1232 本题每空2分
题目分析:(1)少量CaCO3固体溶解得到Ca2+和CO32‾,所以表达式为:CaCO3(s)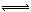 Ca2+(aq)+CO32‾(ag)
Ca2+(aq)+CO32‾(ag)
(2)多元弱酸和其正盐反应生成酸式盐,所以当大气中CO2含量升高时,CO2、H2O与CaCO3发生反应,生成Ca(HCO3)2,化学方程式为:CaCO3+H2O+CO2=Ca(HCO3)2
(3)H2SO3的K1、K2均大于H2CO3的K2,H2SO3的K2小于H2CO3的K1,所以SO2、H2O与CaCO3反应生成Ca(HCO3)2和CaSO3,化学方程式为:2CaCO3+H2O+SO2=Ca(HCO3)2+CaSO3
(4)花岗岩的成分含有Al2O3,当湖水的pH降低到5.0时,为弱酸性,Al2O3与H+反应生成Al3+,Al3+能发生水解反应:Al3++3H2O 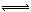 Al(OH)3+3H+,生成的氢氧化铝沉积在鱼鳃表面形成粘膜,所以鱼鳃表面形成粘膜的成分为Al(OH)3。
Al(OH)3+3H+,生成的氢氧化铝沉积在鱼鳃表面形成粘膜,所以鱼鳃表面形成粘膜的成分为Al(OH)3。
(5)第一组数据与其它数据相差较大,实验出现了操作错误,应舍去,由2、3.4求出H+浓度的平均值,为0.1232mol/L
