问题
单项选择题
固体Pb(OH)2溶于250mL·1mol·L-1NaOH溶液中,直到该物质不再溶解为止,Pb(OH)2溶解可视为形成了EPb(OH)3]-。计算有多少克Pb(OH)2溶于含NaOH的溶液中()。
A.3.75g
B.0.75g
C.1.75g
D.2.75g
答案
参考答案:D
解析:
已知K稳{[Pb(OH)3]-}=3.8×1013,Ksp{Pb(OH)2}=1.2×10-15。则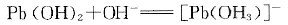
平衡浓度 1-x x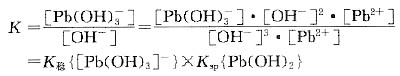
代入已知数据得:
x/(1-x)=3.8×1013×1.2×10-15
x=0.0456mol·L-1
由反应方程式可知溶解的Pb(OH)2的物质的量等于生成的[Pb(OH)3]-的物质的量。溶解的Pb(OH)2的质量为:m=c·V·M=0.0456×0.25×241.2=2.75g
故选(D)。
