问题
单项选择题
已知298K时△rGθ(CH3COOH,aq)=-396.6kJ·mol-1.△rGθ(CH3COO-,aq)=-369.4kJ·mol-1试求算室温下醋酸的电离平衡常数。并判断醋酸溶于水形成浓度为1mol·L-1的溶液时能否自发进行电离()。
A.1.6×10-5自发进行
B.1.7×10-5自发进行
C.1.7×10-5不能自发进行
D.1.6×10-5不能白发进行
答案
参考答案:B
解析:
醋酸的电离方程式为:

电离反应的标准吉布斯自由能变为:
△rGθ=△fGθ(CH3COO,aq)-△fGθ(CH3COOH,aq)
=-369.4-(396.6)=27.2kJ·mol-1
醋酸的电离平衡常数为: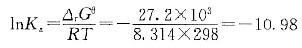
解得 Ka=1.7×10-5
(2)但当CH3COOH(aq)溶于水时,溶液中[H+]=10-7mol·L-1,先求算△rG来判断电离过程能否自发进行。
设[H+]=[CH3COO-]=10-7mol·L-1,[CH3COOH]=1Mol·L-1

=27.2+8.134×298.15×ln(10-7)2
=-52.6kJ·mol-1
△rG<20,CH3COOH(aq)的电离过程是自发进行。
故选(B)。
