工业生产纯械的工艺流程示意图如下
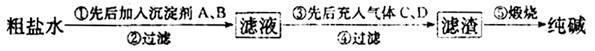
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(A来源于石灰窑厂),则B的化学式_________。
(2)②过滤后滤液中要通入C和D气体,则先通入的C气体是_________(填化学式),原因是_________。
(3)通入C和D气体后发生反应的化学方程式是_________。
(4)④过滤后,向滤液中通氨气,加入细小食盐颗粒,析出副产品________ (填写化学式),通氨气与加入细小食盐颗粒的作用是_________。
(5)写出⑤锻烧发生反应的化学方程式_________。产品纯碱中含有碳酸氢钠,若用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质童分数ω(NaHCO3)= _________ (注明表达式中所用的有关符号的含义)。
(每空2分,第(1)问1分,共计15分)(1)Na2CO3
(2)NH3;因为在CO2水中的溶解度小,而NH3溶解度大
(3)NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
(4)NH4Cl;增大溶液中的Cl-、NH4+的浓度,降低NH4Cl的溶解度,使NH4Cl大量析出
(5)2NaHCO3 Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O; 
题目分析:(1)粗盐提纯时需要除去的杂质离子是Ca2+、Mg2+,A来源于石灰窑厂,则A是生石灰或熟石灰,用来除去Mg2+,而Ca2+一般用碳酸钠来除去,即B试剂是碳酸钠。
(2)由于在CO2水中的溶解度小,而NH3溶解度大,所以要先通入氨气,然后再通入CO2气体。
(3)由于碳酸氢钠的溶解度较小,所以向氨气饱和的氯化钠溶液中通入CO2气体会产生碳酸氢钠晶体,反应的化学方程式是NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl。
(4)由于溶液中含有氯离子和NH4+,所以加入细小食盐颗粒,增大溶液中的Cl-、NH4+的浓度,降低NH4Cl的溶解度,使NH4Cl大量析出,因此析出副产品是氯化铵。
(5)碳酸氢钠稳定性差,在加热的条件下能发生分解,反应的化学方程式为2NaHCO3 Na2CO3+CO2↑+H2O;假设加热前纯碱的质量为m(加热前),加热后的质量为m(加热后),则加热损失的质量为[m(加热前)-m(加热后)],因此根据方程式可知,纯碱中碳酸氢钠的质量为
Na2CO3+CO2↑+H2O;假设加热前纯碱的质量为m(加热前),加热后的质量为m(加热后),则加热损失的质量为[m(加热前)-m(加热后)],因此根据方程式可知,纯碱中碳酸氢钠的质量为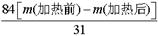 ,所以纯碱中含有的碳酸氢钠的质量分数为
,所以纯碱中含有的碳酸氢钠的质量分数为 。
。
