过氧化钠保存不当容易变质,生成Na2CO3。
(1)某过氧化钠样品已经部分变质,请你选择一种溶液 ,证明过氧化钠已经变质。
(2)某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。
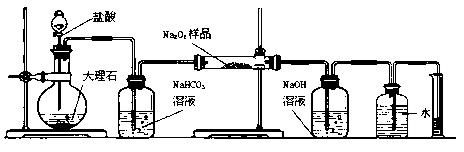
A.
B.
C.
D.(E)(F)上图中的E和F构成量气装置,用来测定O2的体积。
①写出装置B中发生反应的离子方程式:
②NaOH的作用是
③他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为
(1)BaCl2溶液
(2)①HCO3—+H+ = H2O+CO2↑ ②吸收未反应的CO2 ③
题目分析:(1)过氧化钠保存不当容易变质,生成Na2CO3,故检查过氧化钠是否变质,只需检验CO32-,故选用BaCl2溶液。(2)装置B中碳酸氢钠与挥发出来的盐酸反应,离子反应方程式为:①HCO3—+H+ = H2O+CO2↑;②NaOH的作用是吸收未反应的CO2;(3)设样品中过氧化钠的物质的量为:n
2Na2O2 +2H2O═4NaOH+O2↑
2 1
n V×10-3L/22.4L/mol
求得:n= 2V×10-3L/22.4L/mol,故Na2O2的质量为78×2V×10-3L/22.4L/mol,则样品中过氧化钠的质量分数为[(78×2V×10-3g/22.4)/ag] ×100%=

 ____ a month.[ ]
____ a month.[ ]