欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法。
方法四:不使用化学试剂,使用实验室常用仪器。
按要求回答下列问题:
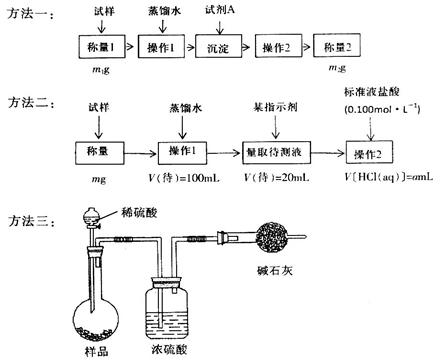
(1)方法一是将HCO3-离子转化为沉淀并称重,则试剂A为______________(填化学式)溶液;操作2包括_______________________。
(2)方法二操作1中要用到的玻璃仪器有烧杯、玻璃棒,还需要___________________;操作2的名称是__________;该样品中NaHCO3的质量分数为_________(用含m、a的表达式表示)。
(3)根据方法三中所用的实验装置,除了称量试样质量外,还需测定的实验数据是_______________;仔细分析该实验装置,由此测得的数据计算出的实验结果有可能偏高也有可能偏低,偏高的原因可能是______________________________;偏低的原因可能是____________________________。
(4)方法四的实验原理是________________(用化学方程式表示)。
(9分)(1)Ba(OH)2[或Ca(OH)2];过滤、洗涤、干燥(有错不得分)
(2)100ml容量瓶、胶头滴管;中和滴定;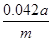 (或
(或 )
)
(3)m(CO2)(或实验前后干燥管的质量);空气中的二氧化碳、水蒸气等进入干燥管;装置中的二氧化碳没有完全排入干燥管
(4)2NaHCO3 Na2CO3+H2O+CO2↑(每空1分)
Na2CO3+H2O+CO2↑(每空1分)
题目分析:(1)要将HCO3-离子转化为沉淀并称重,则需要加入强碱氢氧化钡或氢氧化钙,化学式分别为Ba(OH)2或Ca(OH)2;不溶性物质从溶液中分离出的操作是过滤,所得的沉淀还需要经过洗涤并干燥后才能称量。
(2)要配制100ml待测液,则操作1中要用到的玻璃仪器除了有烧杯、玻璃棒外,还需要100ml容量瓶,以及定容时的胶头滴管。标准盐酸滴定碳酸氢钠溶液,所以操作2的名称是中和滴定;20ml待测液消耗盐酸的物质的量是a×10-4mol,则根据方程式NaHCO3+HCl=NaCl+H2O+CO2↑可知,原样品中碳酸氢钠的物质的量是a×10-4mol×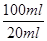 =5a×10-4mol,其质量=5a×10-4mol×84g/mol=0.042ag,所以该样品中NaHCO3的质量分数为
=5a×10-4mol,其质量=5a×10-4mol×84g/mol=0.042ag,所以该样品中NaHCO3的质量分数为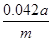 。
。
(3)碳酸氢钠与盐酸反应生成CO2,则通过计算CO2的质量即可以算出碳酸氢钠的含量,所以根据方法三中所用的实验装置,除了称量试样质量外,还需测定的实验数据是m(CO2)或实验前后干燥管的质量;由于干燥管与大气相连,所以空气中的二氧化碳、水蒸气等进入干燥管,导致测量结果偏高;由于装置中的二氧化碳没有完全排入干燥管,还有残余,因此会导致测量结果偏低。
(4)由于碳酸氢钠不稳定,受热易分解生成碳酸钠、水和CO2,据此也可以测量碳酸氢钠的含量,所以方法四的实验原理是2NaHCO3 Na2CO3+H2O+CO2↑。
Na2CO3+H2O+CO2↑。
