为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题:
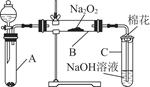
(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃,甲同学因此认为SO2与Na2O2的反应不同于CO2。请按甲同学的观点写出反应的化学方程式 。
(2)乙同学认为无论反应原理如何,最终都有O2产生,乙同学的理由是 。按照乙同学的观点,该装置需做的改进是
。
(3)假设Na2O2完全反应,反应后B装置中固体生成物可能是:①Na2SO3;②Na2SO4;③Na2SO3和Na2SO4。
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成下表:
限选试剂:2 mol·L-1 HCl溶液,1 mol·L-1 HNO3溶液,1 mol·L-1 BaCl溶液,1 mol·L-1 Ba(NO3)2溶液,0.01 mol·L-1 KMnO4酸性溶液。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中 | 固体完全溶解 |
| 步骤2:往Ⅰ试管中加入 ,再滴加 | , |
| 则证明生成物中含Na2SO4 | |
| 步骤3:往Ⅱ试管中 | |
| 若 , | |
| 则证明生成物中有Na2SO3;若 | |
| 则说明生成物中没有Na2SO3。 |
(4)生成物中亚硫酸钠含量的测定:
①取a g生成物配制成100 mL溶液,取10.00 mL该溶液于锥形瓶中,加入几滴淀粉溶液作指示剂,用0.010 0 mol·L-1碘水进行滴定,滴定终点现象为 。记录数据,重复滴定2次,平均消耗碘水20.00 mL。
②计算:生成物中亚硫酸钠的质量分数为 。
(1)SO2+Na2O2=Na2SO4
(2)A中生成的SO2气体中含有水蒸气
在A和B之间连接一个装有浓硫酸的洗气瓶(或其他合适的干燥装置)
(3)
| 步骤2:往Ⅰ试管中加入足量的1_mol·L-1盐酸,再滴加1_mol·L-1_BaCl2溶液 | 有白色沉淀生成,则证明生成物中含Na2SO4 |
| 步骤3:往Ⅱ试管中加入2~3滴0.01_mol·L-1_KMnO4酸性溶液,振荡 | 若KMnO4溶液紫红色褪去,则证明生成物中有Na2SO3; |
| 若KMnO4溶液紫红色不褪去,则说明生成物中没有Na2SO3 |
②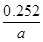 ×100%
×100%
(1)~(2)实验的原理可解读为:将反应后所得气体通过足量NaOH溶液除去过量SO2后,该气体不能使带火星木条复燃说明反应中没有O2生成;而乙同学的观点是考虑到水蒸气的影响,故需要设计实验将气体干燥后再用带火星木条检验是否为O2。(3)根据假设中的三种情况,设计实验的目的就是检验所得固体中是否含有SO42-和SO32-,SO42-的检验可利用BaCl2和稀盐酸;SO32-的检验可根据其还原性,利用溶液是否能使酸性高锰酸钾溶液褪色来进行。(4)①滴定过程中发生的反应为H2O+SO32-+I2=2I-+SO42-+2H+,故滴定终点时的现象为溶液出现蓝色,且半分钟内不褪色。②由①中离子方程式可得关系式Na2SO3~I2,故生成物中亚硫酸钠的质量分数为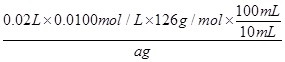 ×100%=
×100%=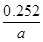 ×100%。
×100%。
