教材中给出了Na2O2与H2O反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑。为了探究Na2O2与H2O反应的机理,某学习探究小组在教师指导下设计了如图所示装置进行实验。
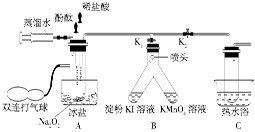
实验步骤如下:
①按图示组装仪器,并检查装置气密性为良好后装入药品。
②保持K1打开、K2关闭,将注射器中的蒸馏水推入试管中,此时试管中并无气体产生。
③挤压装有酚酞的胶头滴管,使酚酞滴入试管中,试管中溶液显红色。
④挤压装有稀盐酸的胶头滴管,使稀盐酸滴入试管中,红色消失后再滴加2滴。
⑤用双连打气球向A中试管中鼓气,使试管中溶液通过喷头进入B中支管中,发现淀粉-KI溶液变蓝,KMnO4溶液褪色。
⑥迅速打开K2、关闭K1,继续向A中试管中鼓气,待试管中溶液进入C中试管中约三分之一时停止鼓气。然后用热水浴加热C中试管片刻,有气泡冒出,经检验为氧气。
请回答下列问题:
(1)用离子方程式表示淀粉-KI溶液变蓝的原因:_____________________________
________________________________________________________________________。
(2)用离子方程式表示KMnO4溶液褪色的原因: ______________________________
________________________________________________________________________。
(3)A中用冰盐冷浴和C中用热水浴的作用分别是________、______________________。
(4)Na2O2与H2O反应的机理是____________________(用化学方程式表示)。
(1)2I-+2H++H2O2=I2+2H2O
(2)2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
(3)防止生成的H2O2分解 使H2O2分解
(4)Na2O2+2H2O=2NaOH+H2O2,2H2O2 2H2O+O2↑
2H2O+O2↑
开始试管中无气体生成,滴入酚酞,溶液变红色,说明Na2O2与H2O反应生成了碱和H2O2,然后滴入的稀盐酸中和NaOH,H2O2在C中分解生成O2。(1)H2O2有强氧化性能氧化I-。(2)H2O2使KMnO4溶液褪色,体现了其还原性。(3)A中用冰盐冷浴,防止温度过高H2O2分解,C中用热水浴可使H2O2分解。(4)Na2O2与H2O反应生成H2O2,H2O2遇热分解。
