海水是一种丰富的资源,工业上从海水中可提取许多种物质,广泛应用于生活、生产、科技等方面。下图是某工厂对海水资源进行综合利用的示意图。
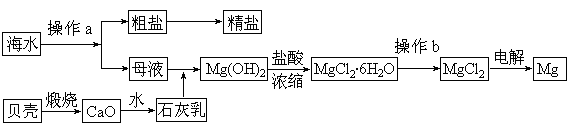
回答下列问题:
(1)流程图中操作a的名称为 。
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①已知气体A、B是CO2或NH3,则气体A应是 (填化学式)。
②灼烧晶体C的反应方程式为 。
③滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却后,可析出不含有NaHCO3的副产品NH4Cl晶体,则通入NH3的作用是 。
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
① 若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是: 。
② 通过操作b获得无水MgCl2是在 氛围中进行,若直接在空气中加热,则会生成Mg(OH)Cl,写出有关反应的化学方程式: 。
(1)蒸发结晶(或蒸发)………(2分)
(2)①NH3……(2分)
②2NaHCO3 Na2CO3+CO2↑+H2O……… (2分)
Na2CO3+CO2↑+H2O……… (2分)
③增加NH4+的浓度,有利于沉淀平衡向生成NH4Cl的方向进行,并将NaHCO3转化为Na2CO3而不析出。………(两点各1分,共2分)
(3)①用铂丝蘸取少量固体,置于酒精灯火焰上灼烧,若无黄色火焰产生,则证明所得无水氯化镁晶体中不含氯化钠。………(2分)(或答焰色反应也给分)
②HCl(气流)……(2分) MgCl2·6H2O Mg(OH)Cl+HCl↑+5H2O↑……(2分)
Mg(OH)Cl+HCl↑+5H2O↑……(2分)
题目分析:(1)由流程图可知是从海水中分离出粗盐,即从溶液中分离出溶质,故用蒸发结晶的方法。
(2)①由于二氧化碳在水中的溶解度很小,而氨气极易溶于水,溶液显碱性,所以制取碳酸氢钠的方法是向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱,因此A是氨气。
②C是碳酸氢钠,不稳定加热易分解生成碳酸钠、二氧化碳和水,所以灼烧晶体C的反应方程式为2NaHCO3 Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
③由于氨气溶于水后生成氨水,氨水电离成铵根和氢氧根离子,增大铵根的浓度有利于氯化铵的析出,所以通入氨气的作用是增加NH4+的浓度,有利于沉淀平衡向生成NH4Cl的方向进行,并将NaHCO3转化为Na2CO3而不析出。
(3)①要验证所得无水MgCl2中不含NaCl,最简单的操作方法是焰色反应,即用铂丝蘸取少量固体,置于酒精灯火焰上灼烧,若无黄色火焰产生,则证明所得无水氯化镁晶体中不含氯化钠。
②如果直接在空气中加热MgCl2•6H2O,则Mg2+会水解的生成Mg(OH)Cl和HCl,通入HCl可以抑制其水解;其反应方程式为MgCl2·6H2O Mg(OH)Cl+HCl↑+5H2O↑。
Mg(OH)Cl+HCl↑+5H2O↑。
