取A、B两份物质的量浓度相等的NaOH溶液,体积均为50 mL,分别向其中通入一定量的CO2后,再分别稀释为100 mL。
(1)在NaOH溶液中通入一定量的CO2后,溶液中的溶质的组成可能是:
① ;② ;③ ;④ 。
(2)在稀释后的溶液中分别逐滴加入0.1 mol·L-1的盐酸,产生的CO2的体积(标准状况)与所加盐酸的体积关系如图所示。
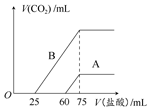
①分别加入足量的盐酸后,溶液中的溶质是 ,原NaOH溶液的物质的量浓度是 。
②A曲线表明,通入CO2后,溶液中的溶质是 ,与盐酸反应产生CO2的最大体积是 mL(标准状况)。
③B曲线表明,原NaOH溶液通入CO2后,所得溶质的化学式为 ,其物质的量之比为 。
(1)①Na2CO3和NaOH ②Na2CO3③Na2CO3和NaHCO3④NaHCO3 (2)①NaCl或NaCl和HCl;0.15 mol·L-1②NaOH和Na2CO3;33.6 ③Na2CO3和NaHCO3;1:1。
(1)在NaOH溶液中通入一定量的CO2后,发生的反应有:2NaOH+CO2=Na2CO3+H2O,Na2CO3+H2O+CO2=2NaHCO3(CO2足量)。该反应过程分步进行,故据反应的CO2的量的不同,溶液中的溶质组成可能出现以下几种情况:①Na2CO3和NaOH;②Na2CO3;③Na2CO3和NaHCO3;④NaHCO3。(2)分析可知,产生气体的反应均为:NaHCO3+HCl=NaCl+H2O+CO2↑,据Na、Cl元素守恒知,c(NaOH)=n(NaOH)/V(NaOH)=n(HCl)/V(NaOH)=(75×10-3L×0.1 mol·L-1)/(50×10-3L)=0.15 mol·L-1。由A曲线及NaHCO3+HCl=NaCl+H2O+CO2↑知,生成的n(CO2)=15×10-3L×0.1 mol·L-1=1.5×10-3 mol(即33.6 mL),即A中刚开始产生气体时n(NaHCO3)=1.5×10-3 mol,产生气体与未产生气体的物质消耗HCl的体积比为1:4,可知A的溶质为NaOH和Na2CO3。结合B曲线知,产生气体与未产生气体的物质消耗HCl的体积比为2:1(Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑),故B中溶质为Na2CO3和NaHCO3,且n(Na2CO3):n(NaHCO3)=1:1。
