纯碱、烧碱等是重要的化工原料。
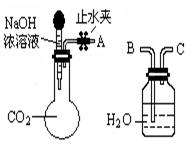
(1)利用下图所示装置可间接证明二氧化碳与烧碱溶液发生了反应:将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是 ,反应的离子方程式是______ _。
(2)向100 mL2 mol/L的NaOH 溶液中通入一定量CO2,充分反应后将溶液在一定条件下蒸发结晶,得到少量的白色固体。试设计实验确认该白色固体的成分。
①提出合理假设。
假设1:该白色固体为NaOH和Na2CO3;
假设2:该白色固体为只有Na2CO3;
假设3:该白色固体为只有NaHCO3;
假设4:该白色固体为Na2CO3和NaHCO3
②基于假设4,设计实验方案进行实验证明固体的成分是Na2CO3和NaHCO3。请在答题卡上写出实验步骤及预期现象和结论。(步骤可不填满也可增加)
限选实验试剂及仪器: 1moL·L–1HCl溶液、1mol·L–1 MgCl2溶液、0.5mol·L–1BaCl2溶液、1mol·L–1 Ba(OH)2溶液、甲基橙试液、酚酞试液、试管、胶头滴管、过滤装置。
| 实验步骤 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: |
(1)水沿导管由广口瓶进入烧瓶(或:水倒吸进入烧瓶)(2分)
2OH–+CO2=CO32–+H2O(或OH–+CO2=HCO3–)(3分)
(2)
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量白色固体于试管中,加适量水溶解,再加0.5mol·L–1BaCl2溶液至过量(3分) | 产生白色沉淀,说明固体中含有Na2CO3; (2分) |
| 步骤2:过滤,取少量滤液(或:静置,用胶头滴管取上层清液少许)于试管中,再向试管中滴加少量Ba(OH)2溶液(3分) | 产生白色沉淀,说明固体中含有NaH CO3。 (2分) |
题目分析:(1)将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,二氧化碳与烧碱溶液发生了反应,引起压强减小,导致水沿导管由广口瓶进入烧瓶,反应的离子方程式为2OH-+CO2=CO32-+H2O(或OH-+CO2=HCO3-),若其它操作不变,若将A与C连接,外界气体进入进入集气瓶,可观察到的现象是广口瓶中的长导管口有气泡产生。(2)证明含有碳酸钠可采用BaCl2溶液,若产生白色沉淀,说明固体中含有Na2CO3;证明含有碳酸氢钠可取上面步骤中的滤液,滴加Ba(OH)2溶液,若产生白色沉淀,说明固体中含有NaH CO3。
