有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,
通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。

(1)加热前通入空气的目的是 ,
操作方法为 。
(2)装置A、C、D中盛放的试剂分别为:A ,
C ,D 。
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl的含量将 (填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将 ;若撤去E装置,则测得Na2CO3·10H2O的含量将 。
(4)若样品质量为w g,反应后C、D增加的质量分别为m1 g、m2 g,由此可知混合物中NaHCO3的质量分数为 (用含w、m1、m2的代数式表示)。
(1)除去装置中的水蒸气和二氧化碳 关闭b,打开a,缓缓通入空气,直至a处出来的空气不再使澄清石灰水变浑浊为止
(2)碱石灰 无水硫酸铜(或无水CaCl2、P2O5等) 碱石灰
(3)偏低 无影响 偏低
(4) 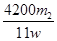 %
%
(2)A、C、D都是U形管,不能盛液体试剂,只能盛固体试剂。A处试剂必须同时吸收CO2和水蒸气。故A处盛的是碱石灰;C、D两处分别吸收水蒸气和CO2,故C处可盛无水硫酸铜(或无水CaCl2、P2O5等),D处可盛碱石灰。
(3)若A装置盛放NaOH溶液只吸收CO2,不吸收水蒸气,则混合物中产生水蒸气的Na2CO3·10H2O和NaHCO3的总质量在计算中会增大,因此测得的NaCl的含量会偏低;若B中反应管右侧有水蒸气冷凝,则水蒸气总质量减小,Na2CO3·10H2O和NaHCO3的总质量在计算中会减小,但是NaHCO3的质量是根据CO2的质量进行计算,所以测得的NaHCO3的含量不受影响;若撤去E装置,则D装置可吸收来自外界空气中的CO2,使得NaHCO3的质量在计算中会增大,故测得的Na2CO3·10H2O的含量会偏低。
(4)NaHCO3的质量分数: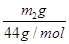 ×2×84 g·mol-1÷w g×100%=
×2×84 g·mol-1÷w g×100%=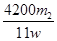 %。
%。
