如图所示装置,可用来粗略测定空气里氧气的含量.实验时先在集气瓶里加入少量水,做上记号.用弹簧夹夹紧乳胶管.点燃燃烧匙内的红磷后,立即伸入瓶中并把塞子塞紧.待红磷熄灭后,发现红磷还有剩余,冷却,打开弹簧夹,烧杯中的水倒流进集气瓶中,液面上升到图中A位置.由此实验不能得到的结论是( )
A.空气中氧气的含量约为1 5
B.氮气不易溶于水
C.氮气不支持燃烧
D.空气中氮气的含量为78%
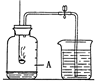
测定空气中氧气含量的原理是利用磷燃烧只消耗氧气,且不生成新气体,由于氧气被消耗,瓶内气压减小,水倒吸入瓶内,进入水的体积即为空气中氧气的体积.
A、红熄灭后烧杯中的水倒流进集气瓶中,液面上升到图中A位置,即原瓶中空气体积的
,所以正确.1 5
B、红磷熄灭后集气瓶中剩余的气体主要是氮气,由于液面不再变化,可知氮气不易溶于水,所以正确.
C、红磷熄灭后集气瓶中剩余的气体主要是氮气,说明氮气不支持燃烧,所以正确.
D、红磷熄灭后液面上升到图中A位置,即原瓶中空气体积的
,说明空气中氧气的含量约为1 5
,而氮气约为1 5
,不能精确到78%,所以错误.4 5
故选D.

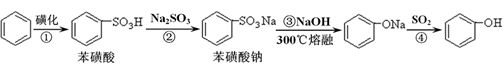
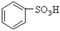 B.
B.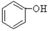 C.H2SO3
C.H2SO3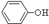 外、可能还含有OH-、SO32-、HSO3-等微粒。请设计实验方案,证明溶液中存在
外、可能还含有OH-、SO32-、HSO3-等微粒。请设计实验方案,证明溶液中存在