我国化工专家侯德榜,勇于创新,改进氨碱法设计了“联合制碱法”,为世界制碱工业作出了突出贡献。请完成下列问题:
(1)“联合制碱法”制得的“碱”是 (填化学式)。
(2)氨碱法和联合制碱法是两大重要的工业制碱法,下列表达中,不正确的是 。
| 氨碱法 | 联合制碱法 | ||
| A | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
| B | 可能的副产物 | 氯化钙 | 氯化铵 |
| C | 循环物质 | 氨气、二氧化碳 | 氯化钠 |
| D | 评价 | 原料易得;设备复杂;能耗高 | 原料利用率高;废弃物少 |
某实验小组,利用下列装置模拟“联合制碱法”。
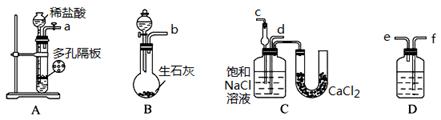
(3)取上述仪器连接装置,顺序为:(a)接( )、( )接( );(b)接( );
检验气密性后装入药品,应该先让 装置(填上述字母)先发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体。
(4)C中用球形干燥管而不用直导管,其作用是 ,D中应选用的液体为 ;
(5)C中广口瓶内产生固体的总化学方程式为 。
(6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为: (注明你的表达式中所用的有关符号的含义)。
(1)Na2CO3
(2)A.C
(3)f e d c (2分) B
(4)防倒吸 饱和NaHCO3溶液
(5)CO2+NH3+NaCl+H2O→NaHCO3↓+NH4Cl
(6)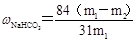 ( m1为样品质量,m2为加热后产品的质量)
( m1为样品质量,m2为加热后产品的质量)
题目分析:(1)“联合制碱法”制得的“碱”是碳酸钠,化学式为Na2CO3。
(2)A、氨碱法原料有:食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气,联合制碱法原料有:食盐、氨气、二氧化碳,故A错误;B、氨碱法可能的副产物为氯化钙,联合制碱法可能的副产物氯化铵,故B正确;C、氨碱法循环物质:氨气、二氧化碳,联合制碱法循环物质:氯化钠,二氧化碳,故C错误;D、氨碱法原料(食盐和石灰石)便宜,产品纯碱的纯度高,副产品氨和二氧化碳都可以回收循环使用,制造步骤简单,适合于大规模生产,但设备复杂;能耗高,氨碱法的最大缺点还在于原料食盐的利用率只有72%~74%;联合制碱法最大的优点是使食盐的利用率提高到96%以上,废弃物少,故D正确,答案选AC。
(3)A装置是制备CO2,B装置是制备NH3,由于氨气极易溶于水需要用干燥管防止倒吸,另外CO2中的氯化氢气体还需要除去,因此正确的连接顺序为(a)接(f)、(e)接(d);(b)接(c)。由于CO2在水中的溶解度小,因此要首先产生氨气,然后再通入CO2气体,所以应该先让B装置先发生反应。
(4)氨气极易溶于水,因此C中用球形干燥管而不用直导管的作用是防倒吸。除去CO2中的氯化氢气体应该用饱和NaHCO3溶液,即D中应选用的液体为饱和NaHCO3溶液。
(5)C装置是制备碳酸氢钠的,所以C中广口瓶内产生固体的总化学方程式为CO2+NH3+NaCl+H2O→NaHCO3↓+NH4Cl。
(6)设m1为样品质量,m2为加热后产品的质量,则根据碳酸氢钠分解的方程式可知
2NaHCO3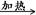 Na2CO3+H2O+CO2↑ 固体质量减少△m
Na2CO3+H2O+CO2↑ 固体质量减少△m
168g 106g 62g
X m1-m2
解得X=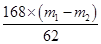
所以纯碱中碳酸氢钠的质量分数可表示为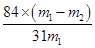 。
。
